Гибридизация электронных орбиталей и геометрия молекул. Структурная формула sf6Шестифтористая сера — Викизнание... Это Вам НЕ Википедия!Гексафторид серы (шестифтористая сера, элегаз, SF6)[править]Шестифтористая сера SF6 - бесцветный, нетоксичный, негорючий газ без запаха. Молекула имеет октаэдрическую конфигурацию. Чрезвычайно химически инертен. Не взаимодействует с щелочами, кислотами, окислителями, восстановителями. Устойчив к действию расплавленного натрия. Гексафторид серы очень слабо растворяется в воде; растворяется в неполярных органических растворителях. При атмосферном давлении возгоняется из твердого состояния в газообразное, минуя жидкость. Шестифтористая сера является значительно более эффективным диэлектриком, чем воздух, или сухой азот.
Применение[править]
www.wikiznanie.ru Элегаз — Викизнание... Это Вам НЕ Википедия!Гексафторид серы (шестифтористая сера, элегаз, SF6)[править]Шестифтористая сера SF6 - бесцветный, нетоксичный, негорючий газ без запаха. Молекула имеет октаэдрическую конфигурацию. Чрезвычайно химически инертен. Не взаимодействует с щелочами, кислотами, окислителями, восстановителями. Устойчив к действию расплавленного натрия. Гексафторид серы очень слабо растворяется в воде; растворяется в неполярных органических растворителях. При атмосферном давлении возгоняется из твердого состояния в газообразное, минуя жидкость. Шестифтористая сера является значительно более эффективным диэлектриком, чем воздух, или сухой азот.
Применение[править]
www.wikiznanie.ru 2.Химические реакции, фазовые и структурные превращения. Основные типы и классы химических соединений.1.Основные химические понятия: атом, молекула, атомная и молекулярная массы, моль и молярная масса, химический элемент, простые вещества и химические соединения. Степень окисления и валентности элемента. Атом — наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и электронов. Молекула—электрически нейтральная частица, состоящая из двух или более связанных ковалентными связями атомов, наименьшая частица химического вещества, обладающая всеми его химическими свойствами. Атомная масса, относительная атомная масса — значение массы атома, выраженное в атомных единицах массы. Молекулярная масса — масса молекулы, выраженная в атомных единицах массы. Численно равна молярной массе. Однако следует чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и различаются по размерности. моль — это количество вещества, масса которого, выраженная в граммах, численно равняется его массе в атомных единицах массы. Молярная масса вещества — масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м. (атомная единица массы). Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности. Химический элемент — совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Каждый химический элемент имеет свои название и символ, которые приводятся в Периодической системе элементов Дмитрия Ивановича Менделеева. Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента (из гомоядерных молекул) Химическое соединение — сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов (гетероядерные молекулы). Степень окисления (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов. Валентность — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов. Химическая реакция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число, изотопный состав химических элементов, при этом происходит перераспределение электронов и ядер и образуются новые химические вещества. Химические реакции происходят при смешении или физическом контакте реагентов самопроизвольно, при нагревании, участии катализаторов (катализ), действии света (фотохимические реакции), электрического тока (электродные процессы), ионизирующих излучений (радиационно-химические реакции), механического воздействия (механохимические реакции), в низкотемпературной плазме (плазмохимические реакции) и т. п Фазовый переход (фазовое превращение) — переход вещества из одной термодинамической фазы в другую при изменении внешних условий. ??? типы хим. св.: ковалентная, ионная, металлическая, водородная, Ван-дер-ваальсова (межмолекулярная) связь. Классы хим. соед.: Оксиды – соединения элемента с кислородом, имеющим степень окисления –2. Общая формула ЭmOn. Основания – сложные вещества, молекулы которых состоят из атома металла (или иона Nh5+) и одной или нескольких гидроксогрупп ОН, способных замещаться на кислотный остаток. Общая формула оснований Ме(ОН)х, где х – степень окисления металла. Кислоты – сложные вещества, содержащие атомы водорода, которые могут замещаться катионами металла (или ионами аммония). Общая формула кислот НхАn. Соли – продукты замещения (полного или частичного) атомов водорода в молекулах кислот катионами металла (а также ионами аммония), либо гидроксогрупп в молекулах оснований кислотными остатками. Соли делятся на средние, кислые, основные, двойные, смешанные и комплексные. 3.Классы неорганических соединений. Химические и структурно-графические формулы, способы получения соединений.классы неорг. соед: оксиды, гидрооксиды(основания), кислоты, соли. Структурная формула — это разновидность химической формулы, графически описывающая расположение и порядок связи атомов в соединении, выраженное на плоскости. Связи в структурных формулах обозначаются валентными черточками. Химическая формула-это условная запись состава вещества посредством химических знаков и индексов. Например: h3O-формула воды, где Н и О-химические знаки элементов, 2-индекс, который показывает число атомов данного элемента, входящих в состав молекулы воды. ????? 4.Стехиометрические законы (шесть) и их современное толкование.1) закон сохр. масс в хим. реакции.(масса исходных веществ в хим. р-ции примерно равна общей массе продуктов р-ции.) 2) закон эквивалентов(В молекулярных соединениях массы составляющих их элементов относятся между собой как их эквиваленты.) 3) постоянство состава хим. соед. с молекулярной структурой.( Химическое соединение, имеющее молекулярное строение, независимо от метода получения характеризуется постоянным составом.) 4) закон кратных отношений Дальмона.( Если два элемента образуют между собой несколько молекулярных соединений, то масса одного элемента, приходящаяся на одну и ту же массу другого, относятся между собой как небольшие целые числа.) 5) закон объёмных кратных отношений (При равных условиях объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов, как небольшие целые числа.) 6) закон авагадро (В равных объемах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул.) studfiles.net Гибридизация электронных орбиталей и геометрия молекулВ 1930 г. Слейтером и Л. Полингом была развита теория образования ковалентной связи за счет перекрывания электронных орбиталей – метод валентных связей. В основе этого метода лежит метод гибридизации, который описывает образование молекул веществ за счет «смешивания» гибридных орбиталей («смешиваются» не электроны, а орбитали). Определение типа гибридизации молекул с ковалентной связьюОпределить тип гибридизации можно только для молекул с ковалентной связью типа АВn, где n больше или равно двум, А – центральный атом, В – лиганд. В гибридизацию вступают только валентные орбитали центрального атома. Определим тип гибридизации на примере молекулы Beh3. Первоначально записываем электронные конфигурации центрального атома и лиганда, рисуем электронно-графические формулы. 4Be 1s22s2  1h2s1  Атом бериллия (центральный атом) имеет вакантные 2p-орбитали, поэтому, чтобы принять по одному электрону от каждого атома водорода (лиганд) для образования молекулы Beh3 ему необходимо перейти в возбужденное состояние: 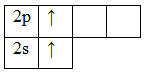 Образование молекулы Beh3 происходит за счет перекрывания валентных орбиталей атома Be  * красным цветом обозначены электроны водорода, черным – бериллия. Тип гибридизации определяют по тому, какие орбитали перекрылись, т.о., молекула Beh3 находитс в sp – гибридизации.
Помимо молекул состава ABn, методом валентных связей можно определить тип гибридизации молекул с кратными связями. Рассмотрим на примере
молекулы этилена C2h5. В молекуле этилена кратная двойная связь, которая образована 6C 2s22s22p2  1h2s1  У атома углерода имеется еще одна вакантная p-орбиталь, следовательно, чтобы принять 4 атома водорода ему необходимо перейти в возбужденное состояние: 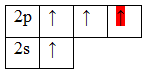
Одна p-орбиталь необходима для образования Определение геометрической структуры молекулГеометрическую структуру молекул, а также катионов и анионов состава АВn можно с помощью метода Гиллеспи. В основе этого метода – валентные пары электронов. На геометрическую структуру оказывают влияние не только электроны, участвующие в образовании химической связи, но и неподеленные электронные пары. Каждую неподеленную пару электронов в методе Гиллеспи обозначают Е, центральный атом – А, лиганд – В. Если неподеленных электронных пар нет, то состав молекул может быть АВ2 (линейная структура молекулы), АВ3 (структура плоского треугольника), АВ4 (тетраэдрическая структура), АВ5 (структура тригональной бипирамиды) и АВ6 (октаэдрическая структура). От базисных структур могут быть получены производные, если вместо лиганда появляется неподеленная электронная пара. Например: АВ3Е (пирамидальная структура), АВ2Е2 (угловая структура молекулы). Чтобы определить геометрическую структуру (строение ) молекулы необходимо определить состав частицы, для чего вычисляют количество неподеленных лектронных пар (НЕП): НЕП = (общее число валентных электронов – число электронов, пошедших на образование связи с лигандами) / 2 На связь с H, Cl, Br, I, F уходит по 1-му электрону от А, на связь с O – по 2 электрона, а на связь с N – по 3 электрона от центрального атома. Рассмотрим на примере молекулы BCl3. Центральный атом – B. 5B 1s22s22p1 НЕП = (3-3)/2 = 0, следовательно неподеленных электронных пар нет и молекула имеет структуру АВ3 – плоский треугольник. Подробно геометрическое строение молекул разного состава представлено в табл. 1. Таблица 1. Пространственное строение молекул
Примеры решения задачru.solverbook.com |
|
||||||||||||||||||
|
|
||||||||||||||||||
|




 и
и  –связями. Чтобы определить гибридизацию,
записываем электронные конфигурации и рисуем электронно-графические формулы атомов, входящих в состав молекулы:
–связями. Чтобы определить гибридизацию,
записываем электронные конфигурации и рисуем электронно-графические формулы атомов, входящих в состав молекулы:










