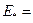Способ получения титаната кальция. Кальция титанатТитанат кальция - Справочник химика 21Сущность способа заключается в спекании бокситов с содой и известняком в трубчатых вращающихся печах. Полученный спек охлаждают и выщелачивают промывными водами. В раствор переходит алюминат натрия, в осадке остается кремнезем в виде двукальциевого силиката, гидроокись железа и титанат кальция. Небольшая часть кремнезема, образующая при спекании растворимый силикат натрия, который не отделяется после выщелачивания и осаждения двукальциевого силиката, удаляется уже из раствора с помощью известкового молока при нагревании в автоклавах. [c.483] При определении в соединениях хрома [319, 320], а также в системе алюминат — лантан — титанат кальций экстрагируют в виде роданидного комплекса из кислой среды трибутилфосфатом [138]. Сг (VI) при этом восстанавливают до Сг(П1) аскорбиновой кислотой [319]. [c.58]Из смеси алюмината лантана и титаната кальция кальций отделяют на фоне комплексона III и глюкозы [1381. После выделения кальций определяют фотометрически или комплексонометрически. [c.171] Для процесса восстановления двуокиси титана углеродом с выделением СО lg/ =0,98 при 2000° К, однако одновременно с металлом при зтом образуется карбид. Восстановление карбидом кальция невозможно не только из-за образования карбида, но и вследствие образования титаната кальция, восстанавливающегося труднее, чем двуокись титана. При сравнительно низкой температуре с достаточной полнотой протекает реакция [c.231] Алюминат лантана — титанат кальция Алюминий и его сплавы (в пересчете на А1) Алюминия нитрид [c.311] Алюминат лантана — титанат кальция 6 а 4 [c.309] Титанат кальция 10 130 Параэлектрик смещения [c.390]Титанат кальция (СаТЮз) 7,0 [c.29] Титанат кальция (СаТЮз) [c.31] Титанат кальция (СаТЮз) [c.182] Электрические и оптические свойства синтетического кристалла титаната кальция. [c.191]ЭКСТРАКЦИОННО-КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ КАЛЬЦИЯ В СИСТЕМЕ АЛЮМИНАТ ЛАНТАНА-ТИТАНАТ КАЛЬЦИЯ [c.292] Определение кальция в системе алюминат лантана—титанат кальция представляет большие трудности, обусловленные мешающим влиянием алюминия, титана и лантана. Применение гравиметрического оксалатного метода [1] в данном случае невозможно, так как лантан также осаждается оксалатом [2] и, кроме того, метод длителен. Комплексонометрическое титрование также неприменимо, так как А1, Т1 и Ьа в условиях титрования кальция гидролизуются с образованием осадков. [c.292] Из табл. 1 видно, что применение экстракции кальция в виде роданидных комплексов позволяет отделять и определять его в системе алюминат лантана — титанат кальция с хорошей воспроизводимостью (Отдельные отклонения не превышают 0,56% относительных). [c.292] На основании проведенных исследований рекомендуется следующая методика определения кальция в системе алюминат лантана — титанат кальция. [c.294] Введение в шихту флюсов СаО или СаСОз облегчает и ускоряет восстановление железа вследствие разрушения ильменита и образования более прочного титаната кальция aTiOg (перовскита). Температура плавления шлаков уменьшается вследствие образования эвтек-тик и уменьшения содержания в них низших окислов титана, так как связанная TiOj восстанавливается труднее. Шлаки становятся менее вязкими, что облегчает отделение корольков железа. При плавке с [c.250] Какое соединение кальция мол[c.318] Титан сильно занижает количество свободных атомов и ионов кальция в исследуемом растворе [463, 1200, 1346]. В пламени кальций связывается титаном с образованием термически устойчивого титаната кальция (GaTiOg) [227, 460, 463]. Вследствие этой реакции уменьшается количество свободных атомов кальция и некоторых его активных в пламени молекулярных соединений. Влияние небольших количеств титана устраняют использованием солей стронция в качестве внутреннего стандарта или связывают титан комплексоном III [1200]. Значительные количества титана удаляют осаждением аммиаком [1435] или оксихинолином [1348]. [c.142]
Лошкарев [65], а также Мамыкин и Лошкарев [66] изучили влияние двуокиси титана на процесс спекания СаО и сделали обстоятельный анализ технических свойств огнеупорных изделий из титанатов кальция в свете данных о плавкости системы СаО—ИОг—S1O2 и результатов собственных всесторонних исследований. [c.98] Аналогом катализатора ГИАП-16 является смешанный кальций-алюми-натный катализатор -II-2S фирмы I (США), в состав которого иногда добавляют титанат кальция. Как следует из табл. 11,9, алюминатсодержащие катализаторы смешанного типа содержат 23—26% N10, т. е. в 2—3 раза больше, чем катализаторы нанесенного типа. Они обладают сравнительно вышкой активностью (см. табл. 11,10), но в отличие от катализаторов нанесенного типа эти катализаторы теряют прочность при нагревании в воздухе до температур свыше 800 °С. Катализатор -II-2S теряет от 15 до 40% исходной прочности при нагреве на воздухе до 900 °С. После восстановления водородом и паровой конверсии метана (НгО/СН4=2) в течение 8—10 ч при 800°С катализатор -II-2S теряет от 25 до 60% исходной прочности. [c.71] chem21.info Способ изготовления изделий из титаната кальция1. СПОСОБ ИЗГОТОВЛЕНИЯ ИЗДЕЛИЙ НЗ ТИТАНАТА КАЛЬЦИЯ путем .увлажнения порошка титаната кальция связуюйдим - водным раствором сахарозы , прессования, обжига с изотермическими выдержками при нагреве и конечной температуре и охлаждения , отличающийся тем, что, с целью повышения механической и электрической про1-1ности и снижения брака при обжиге, в связующее вводят тонкодисперсный диоксид титана , выдержку при нагреве проводят в интервале температур 900-1000°С и дополнительную выдержку - при охлаждении в интервале 800-900с в течение 1-3 ч. 2. Способ по п. 1, о т л. и ч аю щ и и с я тем, что увлажнение проводят связующим состава, мас.%: Сахароза 11-13 Тонкодисперсный 6-17 диоксид титана Остальное Вода союз советсних СОЦИАЛИСТИЧЕСНИХ РЕСПУБЛИК (19) (11. 3(5D С 04 В 35 46 ОПИСАНИЕ ИЗОБРЕТЕНИЯ Н ASTOPCHOMY СВИДЕТЕЛЬСТВУ Тонкодисперсный диоксид титана 8-17 Остальное Вода ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И.ОТКРЫТИЙ (21) 3370625/29-33 (22) 25.12.81 (46) 23.02.84. Бюл. Р 7 (72) Л.И. Верба, Э.В.,Дегтярева и В.С. Праско (.71) Украинский научно-исследователь.ский институт огнеупоров (53) 666.651:621{088.8) (56) 1. Патент Великобритании Ф 1053934„ кл. С 1 J, опублик. 1964. 2. Богородицкий Н.П. и др. Радиокерамика, М.-Л., "Госэнергоиэдат", 1963, с. 134, 354, 398, 400-401 (прототип). (54)(57) 1. СПОСОБ ИЗГОТОВЛЕНИЯ ИЗДЕЛИЙ ИЗ THTAHATA КАЛЬЦИЯ путем увлажнения порошка титаната кальция связующим — водным раствором сахароэы, прессования, обжига с изотер мическими выдержками при нагреве и конечной температуре и охлаждения, отличающийся тем, что, с целью повышения механической и электрической прочности и снижения брака при обжиге, в связующее вводят тонкодисперсный диоксид титана, выдержку при нагреве проводят в интервале тещператур 900-1000 С и дополнительную выдержку — при охо лаждении в интервале 800-900 С в течение 1-3 ч. 2. Способ по п. 1, о т л,и ч а ю шийся тем, что увлажнение проводят связующим состава, мас.Ъ: Сахароза 11-13 1074844 Увлажнение производят связующим состава, мас.Ъ: 11-13 Сахароза Тонкодисперсный диоксид титана 8-17 Остальное Вода Способ осуществляется следующим образом. Дисперсный тонкомолотый (10 мкм) титанат кальция увлажняют суспензией дисперсной TiO2 в растворе сахарозы, затем полусухим прессованием формуют изделия в виде дисков Изобретение относится к огнеупор. ной и керамической промышленности и может быть использовано при изготовлении изделий из титаната кальция, предназначенных для работы в установках электротехнической промышленности. Известен способ изготовления керамических изделий путем смешения титаната кальция со связующими веществами, прессования пресс-порошка и спекания отформованных изделий (1). Однако при этом имеет место низкая механическая прочность изделий и их значительный брак при обжиге. Наиболее близким к предлагаемому по технической сущности и достигаемому результату является способ, включающий увлажнение тонкодисперсного титаната кальция раствором сахарозы, формование изделий и обжиг при 1100 }С с выдержкой 4 ч и при 1300 C c выдержкой 2 ч, скорость подъема температуры 100-150ОC/÷. При этом режим обжига включает три стадии: нагрев, выдержку при макси— мальной температуре и охлаждение )2). При обжиге рекомендуется проводить закалку, которая повышает механическую и электрическую прочность керамики, однако такая закалка не позволяет получить крупные иэделия, например диски диаметром 100250 мм без трещин. Цель изобретения — повышение механической и электрической прочности. Поставленная цель достигается тем, что по способу изготовления изделий из титаната кальция путем увлажнения порошка титаната кальция связующим — водным раствором сахарозы, прессования, обжига с изотермическими выдержками при нагреве и конечной температуре и охлаждения, в связующее вводят тонкодисперсный диоксид титана, выдержку при нагреве проводят в интервале температур 900-1000 С и дополнительную выдержку — при охлаждении в интервале 800-900 С в течение О 1-3 ч. диаметром 105 мм (в сырце ) при удельном давлении 500 кг/см на 160-тонном гидравлическом прессе. После сушки проводят обжиг в пламенной печи при 1400 С с тремя выдержками в течение 1-3 ч, одна из которых проводится при нагревании в интервале 900-1000 С, вторая — при 14001430 С, третья — при охлаждении в о интервале 800-900 С. 10 Предлагаемый способ и состав суспензии опробованы при изготовлении изделий из титаната кальция в виде дисков диаметром 90 мм. Пример 1. (но известному 15 способу), Титанат кальция, измельченный до размера зерен (10 мкм, смешивают с раствором сахарозы состава: сахароза 12,5, вода — остальное. Затем прессуют изделия, сушат 2() и обжигают по следУющемУ режиму: 20-1000 С - по 100 C/÷ Выдержка при 1100 С 4 ч 25 1100-1300 С по 500C/÷ Выдержка при 1300 С 1300-1100 С 1100-50 С 2 ч по 150 С/ч по 50 С/ч Выдержка при 900 С 900-1300 С 1300-1400 С Выдержка при 1400 С 1400-800 С 3 ч по 15 С/ч по 10 С/ч 2 ч по 25 С/ч ,о, Выдержка при 800 C 3 ч 50 800-50 С по 30 С/ч Пример 3. Титанат кальция, измельченный до размера зерен е10 мкм, смешивают в суспензией состава: сахароза 12%, TiO2 13%, 55 вода — остальное. Затем из этой массы прессуют диски, их сушат и обжигают по следующему режиму: 20 950оС по 20 С/ч Выдержка при 950 С 2 ч 950-1300 С по 15OC/÷ 1300-1430 С по 10 C/÷ Выдержка при 1430 С 2 ч Пример 2. Титанат кальция, измельченный до размера зерен 10 мкм, смешивают с суспензией т102 в растворе. Сахарозы состава: сахароза 11%, TiOq 8Ъ, вода — остальное. Затем из этой массы прессуют диски, их сушат и обжигают по следующему режиму: 4(} 20-900 С по 20 C/н 1074844 Т10 в растворе сахарозы состаэа: сахароза 10%, TiO 3%, вода - остальное. Затем из этой массы прессуют диски, их сушат и обжигают по следующему режиму: 20-1000 С по 20 С/ч Выдержка при 1000 С о 1000-1 300 С 1300-1400 С Выдержка при 1400 С 1400-900 С Выдержка при 1000-1300 С 1300-1430оС Выдержка при 900 С о 900-50 С о 1 ч по 15 С/ч по 10 С/ч Пример 8. Титанат кальция, измельченный до размера зерен TiO в растворе сахарозы состава: сахароза 14%, Tio 21%, вода — остальное. Затем из этой массы прессуют диски, их сушат и обжигают по следующему режиму: 20-1000 С о по 20 С/ч о Выдержка при 1430 С 1430-900 С Выдержка при 900 С о о 900-50 С 3 ч по 25 С/ч 3 ч по 30 С/ч Выдержка при 1000 С 1000-1300 С 1300-1400 С 3 ч по 15 С/ч о по 10 С/ч Выдержка при 1400 С 1400-800о С 2 ч по 25 С/ч о Выдержка при 800 С 800-50 С 2 ч по 30 С/ч Пример 9. Титанат кальция, измельченный до размера зерен TiO в растворе сахарозы состава: сахароза 12%, T iO 13%, вода — остальное. Затем из этой массы прессуют диски, их сушат и обжигают по следующему режиму: 20-800 С 40 по 20 С/ч о 2 ч по 15 С/ч по 10 С/ч 3 ч по 25 С/ч о Выдержка при 1000 С 1000-1300 С 1300-1400 С Выдержка при 1400 С 1400-850 С 2 ч по 30 С/ч h р и м е р 10. Титанат кальция, измельченный до размера зерен (10 мкм, смешивают с суспензией TiO в растворе сахарозы состава: сахароза 12%, TiO2 13%, вода — остальное. Затем из этой массы прессуют диски, их сушат и обжигают по следующему режиму: Выдержка при 850оС 850-50 С 1430 850оС по 25оС/ч Выдержка при 850 С .З.ч 850 50о по 30 С/ч Пример 4. Титанат кальция, 5 измельченный до размера зерен (10 мкм, смешивают с суспензией сос тава: сахароза 13%, Ti02 17% вода остальное. Затем из этой массы прессуют диски, их сушат и обжигают по 10 следующему режиму: 20-1000 С по 20 С/ч Пример 5. Титанат кальция измельченный до размера зерен 20-900 .С по 20 С/ч Выдержка при 900 С 2 ч о 900-1300 C по 15 C/÷ 1300-1400 С по 10 С/ч Выдержка при 1400оС 2 ч 1400-90>0 С по 25 С/ч Выдержка при 900 С 1 ч 900-50 С по 30 С/ч Пример б. Титанат кальция, измельченный до размера зерен 10 мкм, смешивают с суспензией состава: сахароза 13%, TiOg 17%, вода остальное. Затем из этой массы прессуют диски, их сушат и обжигают по следующему режиму: 20-1000 С по 20 С/ч 2 ч 15 С/v по 10 С/ч 2 ч по 25 С/ч 2 ч 60 по 30 С/ч Пример 7. Титанат кальция, и з мел ьче н ный до ра з мера з ере н 10 мкм, смешивают с суспензией 65 Выдержка при 800 С 800-1300 С 1300-1400 С о Выдержка при 1400 C .1400-700 С о, Выдержка при 700 С 700-50 С 2 ч по 15 C/÷ по 10 С/ч 2 ч по 25 С/ч 3 ч по 30 С/ч 1074844 20-1000 С Выдержка при 1000 С 1000-1300 С по 20 С/ч 1 ч по 15 С/ч по 10 С/ч 5 1300-1400 С Выдержка при 1400 С О 1400-1000 С Выдержка при 1000 С 1000-50 С 2 ч по 25 С/ч 2ч,10 по 30 С/ч В таблице приведены свойства изделий из титаната кальция, полученных по предлагаемому и известному способам. 15 Из таблицы следует, что введение суспенэии тонкодислерсной Т1О в растворе сахарозы при изготовлении Показатели свойств иэделий по примеру E (I 5 3 I Свойства 1 2. 3 4 5 б 7 8 9 10 3,93 3,92 3,93 3,91 3,90 3,88 3,90 Предел .прочности при изгибе, МПа 1000 1750 1780 1800 1760 1780 1650 1580 1340 1550 11,4. 11 2 11,3 9,7 9,2 7 9 8,7 8080701108010,080 Составитель В. Соколова Редактор Н. Егорова Техред Т.Маточка Корректор М. Шароши ЗаКаз 446/21 . Тираж 606 Подписное ВНИИПИ Государств44ного комитета СССР по делам изобретений и открытий 113035, Москва, Ж-35, Раушская наб., д. 4/5 Филиал .ППП "Патент", r. Ужгород, ул. Проектная, 4 Плотность (кажущаяся), г/см> 3,90 3,92 3,93 Электрическая прочность, кВ/мм 10 10,5 11,2 Брак изделий при обжиге, Ф 43 5,0 7,0 I титаната кальция и соответствующий режим обжига изделий обеспечивают значительное повышение механической (до 1750-1800 МПа) и электрической (до 10,5-11,4 кВ/мм) прочности изделий и снижение их брака при обжиге на 35-38 абс.Ъ по сравнению с известным способом (пример 1). При этом за счет введения оптимального количества суспензии Т О в растворе сахароэы для изготовления материала и предлагаемого режима обжига (примеры 2-6) обеспечивается значительное повышение служебных свойств и снижение брака изделий при обжиге по сравнению с примерами 7-10, выходящими за пределы предлагаемых составов суспензий и режимов обжига изделий.     www.findpatent.ru Титанат кальция — Википедия (с комментариями)Материал из Википедии — свободной энциклопедии Титанат кальция — соединение с химической формулой CaTiO3. Как минерал известен под названием перовскит (назван в честь русского минералога Л. А. Перовского (1792—1856)). Первоначально кристаллическая структура перовскита считалась кубической, что послужило основанием для введения структурного типа перовскита, в котором кристаллизуются несколько сотен химических соединений. Позже было выяснено, что структура CaTiO3 немного искажена относительно кубической (при комнатной температуре она является орторомбической, пространственная группа Pnma), а кубическую структуру титанат кальция приобретает только при температуре выше 1260—1300 °C в результате фазового перехода. Титанат кальция является диэлектриком с достаточно высокой диэлектрической проницаемостью (ε ~ 170 при комнатной температуре). Поэтому керамические материалы на его основе используются для изготовления конденсаторов. Титанат кальция получают спеканием CaCO3 с TiO2 при 1100—1200 °C. Напишите отзыв о статье "Титанат кальция"Литература
Отрывок, характеризующий Титанат кальция– Как ни тяжел мне будет этот год, отсрочивающий мое счастье, – продолжал князь Андрей, – в этот срок вы поверите себя. Я прошу вас через год сделать мое счастье; но вы свободны: помолвка наша останется тайной и, ежели вы убедились бы, что вы не любите меня, или полюбили бы… – сказал князь Андрей с неестественной улыбкой. – Зачем вы это говорите? – перебила его Наташа. – Вы знаете, что с того самого дня, как вы в первый раз приехали в Отрадное, я полюбила вас, – сказала она, твердо уверенная, что она говорила правду. – В год вы узнаете себя… – Целый год! – вдруг сказала Наташа, теперь только поняв то, что свадьба отсрочена на год. – Да отчего ж год? Отчего ж год?… – Князь Андрей стал ей объяснять причины этой отсрочки. Наташа не слушала его. – И нельзя иначе? – спросила она. Князь Андрей ничего не ответил, но в лице его выразилась невозможность изменить это решение. – Это ужасно! Нет, это ужасно, ужасно! – вдруг заговорила Наташа и опять зарыдала. – Я умру, дожидаясь года: это нельзя, это ужасно. – Она взглянула в лицо своего жениха и увидала на нем выражение сострадания и недоумения. – Нет, нет, я всё сделаю, – сказала она, вдруг остановив слезы, – я так счастлива! – Отец и мать вошли в комнату и благословили жениха и невесту.wiki-org.ru Способ получения титаната кальция
ОП ИСАНИЕ ИЗОБРЕТЕНИЯ H АВТОРСКОМУ СВИДЕТЕЛЬСТВУ ц 435193 Союз Советских Социалистических Республик (61) Зависимое от авт. свидетельства (22) Заявлено 12.01.71 (21) 1610528/23-26 (51) М. Кл. С Olg 23/00 С 011 11/00 с присоединением заявки № i осударственный комитет Совета Министров СССР Ао делам изобретений и открытий (32) Приоритет Опубликовано 05.07.74. Бюллетень № 25 Дата опубликования описания 18.11.74 (53) УДК 546.824 41.07 (088.8) (72) Авторы изобретения T. П. Лимарь, А, В. Наумов, В, Ф. Гетманец, А. М. Гареев и П. И. Бочко (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ТИТАНАТА КАЛЪЦИЯ 73,72 49 146 — 73,72 Стк, т с, Изобретение относится к способам получения титаната кальция, который может быть использован, например, для изготовления конденсаторной керамики. Известен способ получения титаната кальция путем взаимодействия водного раствора смеси четыреххлористого титана и хлористого кальция с аммиачным раствором карбоната аммония. Образующийся при этом осадок отделяют от раствора и прокаливают. Цель изобретения — ускорение процесса, стабилизация состава конечного продукта, сокращение расхода реагентов и отходов производства — достигается тем, что в качестве исходного раствора, содержащего титан и кальций, используют раствор карбоната кальция в водном растворе четыреххлористого титана. Пример, В качестве сырья для получения титаната кальция используется водный раствор четыреххлористого титана с концентрацией 2,5 — 3 моль/л (содержание TiC14 и устанавливается химическим анализом) и карбонат кальция СаСОЭ. При расчете на получение 10 кг титаната кальция взвешивается (с точностью до 0,1 г) 73, 77,5 г карбоната кальция что составляет 73,72 г моль. Этот продукт высыпается в реактор с мешалкой, куда заливается дистиллированная вода в количестве, рассчитываемом по формуле 73,72 1,5 где 73,72 — количество молей TiC14, необходимое для растворения эквимолекулярного количества карбоната кальция; 10 1,5 — конечная концентрация титана в растворе после разбавления, моль/л; Ст с, — концентрация исходного водно. го раствора четыреххлор истого 15 титана, моль/л. К суспензии карбоната кальция в воде приливается при интенсивном перемешивании рассчетное количество раствора четыреххлористого титана. После полного растворения кар20 боната кальция полученный прозрачный раствор сливается с раствором осадителя, количество которого рассчитывается из соотношения Са+: Ti+ : (Nh5)еСОв. Nh5OH = 1: 1: (0,8 — 0,9): (2,2 — 2,4). 25 Осадок отфильтровывается на нутч-фильтре, промывается водой от хлорид-ионов, сушится в сушилке любой конструкции (лучше всего в сушилке распылительного типа) и прокаливается в печи при 900 — 1100 С в течение 5— 30 6 час. 435193 Составитель В. Забелин Корректор Н. Аук Техред Л. Богданова Редактор Г. Ивченкова Заказ 3114/15 Изд. гй 53 Тираж 537 Подписное ЦНИИПИ Государственного комитета Совета Министров СССР по делам изобретений и открытий Москва, Ж-35, Раушская наб., д. 4/5 Типография, пр. Сапунова, Z Полученный титанат кальция имеет стехиометрический состав, а керамика следующие электрофизические свойства: в 150, 1до(4 10-4. Готовый, продукт используется для изготовления конденсаторов. Предмет изобретения Способ получения титаната кальция путем взаимодействия раствора, содержащего титан и кальций, с аммиачным раствором карбоната аммония с последующим отделением осадка от раствора и его прокаливанием, о т л и ч ающий ся тем, что, с целью ускорения процесса, стабилизации состава конечного продукб та, а также сокращения расхода реагентов и отходов производства, в качестве исходного раствора, содержащего титан и кальций, используют раствор карбоната кальция в водном растворе четыреххлористого титана.   www.findpatent.ru Титанат кальция - WikiVisually1. Перовскит – Perovskite is a calcium titanium oxide mineral composed of calcium titanate. The mineral was discovered in the Ural Mountains of Russia by Gustav Rose in 1839 and is named after Russian mineralogist Lev Perovski and it lends its name to the class of compounds which have the same type of crystal structure as CaTiO3 known as the perovskite structure. The perovskite crystal structure was first described by Victor Goldschmidt in 1926, the crystal structure was later published in 1945 from X-ray diffraction data on barium titanate by Helen Dick Megaw. Found in the Earth’s mantle, perovskite’s occurrence at Khibina Massif is restricted to the ultramafic rocks and foidolites. Perovskite occurs as small anhedral to subhedral crystals filling interstices between the rock-forming silicates, Perovskite is a common mineral in the Ca-Al-rich inclusions found in some chondritic meteorites. A rare earth-bearing variety, knopite, O3) is found in alkali intrusive rocks in the Kola Peninsula and near Alnö, a niobium-bearing variety, dysanalyte, occurs in carbonatite near Schelingen, Kaiserstuhl, Germany. The stability of perovskite in igneous rocks is limited by its relation with sphene. In volcanic rocks perovskite and sphene are not found together, the exception being in an etindite from Cameroon. Perovskites have a structure with general formula of ABO3. In this structure, an A-site ion, on the corners of the lattice, is usually an alkaline earth or rare earth element, B site ions, on the center of the lattice, could be 3d, 4d, and 5d transition metal elements. A large number of elements are stable in the perovskite structure. T = R A + R O2 where RA, RB and RO are the radii of A and B site elements and oxygen. Perovskites have sub-metallic to metallic luster, colorless streak, cube like structure along with imperfect cleavage, colors include black, brown, gray, orange to yellow. Crystals of perovskite appear as cubes, but are pseudocubic and crystallize in the orthorhombic system, Perovskite crystals have been mistaken for galena, however, galena has a better metallic luster, greater density, perfect cleavage and true cubic symmetry. Perovskites may be structured in layers, with the above ABO3 structure separated by sheets of intrusive material. Their oxide ion-conducting properties were first discovered in the 1970s by Takahashi et al. ruddlesden−Popper phases have a similar relationship to perovskites in terms of atomic radii of elements with A typically being large with the B ion being much smaller typically a transition metal. Calcium titanate Perovskite Post-perovskite Perovskite solar cell Silicate perovskite 2. Ромбическая сингония – In crystallography, the orthorhombic crystal system is one of the 7 crystal systems. All three bases intersect at 90° angles, so the three lattice vectors remain mutually orthogonal, there are two orthorhombic Bravais lattices in two dimensions, Primitive rectangular and centered rectangular. The primitive rectangular lattice can also be described by a centered rhombic unit cell, there are four orthorhombic Bravais lattices, primitive orthorhombic, base-centered orthorhombic, body-centered orthorhombic, and face-centered orthorhombic. In this axis setting, the primitive and base-centered lattices interchange in centering type, crystal structure Overview of all space groups Hurlbut, Cornelius S. Klein, Cornelis. Hahn, Theo, ed. International Tables for Crystallography, Volume A, Space Group Symmetry 3. Фазовый переход – The term phase transition is most commonly used to describe transitions between solid, liquid and gaseous states of matter, and, in rare cases, plasma. A phase of a system and the states of matter have uniform physical properties. For example, a liquid may become gas upon heating to the boiling point, the measurement of the external conditions at which the transformation occurs is termed the phase transition. Phase transitions are common in nature and used today in many technologies, the same process, but beginning with a solid instead of a liquid is called a eutectoid transformation. A peritectic transformation, in which a two component single phase solid is heated and transforms into a phase and a liquid phase. A spinodal decomposition, in which a phase is cooled. Transition to a mesophase between solid and liquid, such as one of the crystal phases. The transition between the ferromagnetic and paramagnetic phases of materials at the Curie point. The transition between differently ordered, commensurate or incommensurate, magnetic structures, such as in cerium antimonide, the martensitic transformation which occurs as one of the many phase transformations in carbon steel and stands as a model for displacive phase transformations. Changes in the structure such as between ferrite and austenite of iron. Order-disorder transitions such as in alpha-titanium aluminides, the dependence of the adsorption geometry on coverage and temperature, such as for hydrogen on iron. The emergence of superconductivity in certain metals and ceramics when cooled below a critical temperature, the superfluid transition in liquid helium is an example of this. The breaking of symmetries in the laws of physics during the history of the universe as its temperature cooled. Isotope fractionation occurs during a transition, the ratio of light to heavy isotopes in the involved molecules changes. When water vapor condenses, the heavier water isotopes become enriched in the liquid phase while the lighter isotopes tend toward the vapor phase, Phase transitions occur when the thermodynamic free energy of a system is non-analytic for some choice of thermodynamic variables. This condition generally stems from the interactions of a number of particles in a system. It is important to note that phase transitions can occur and are defined for non-thermodynamic systems, examples include, quantum phase transitions, dynamic phase transitions, and topological phase transitions. In these types of other parameters take the place of temperature 4. Относительная диэлектрическая проницаемость – The relative permittivity of a material is its permittivity expressed as a ratio relative to the permittivity of vacuum. Permittivity is a property that affects the Coulomb force between two point charges in the material. Relative permittivity is the factor by which the field between the charges is decreased relative to vacuum. Likewise, relative permittivity is the ratio of the capacitance of a capacitor using that material as a dielectric, relative permittivity is also commonly known as dielectric constant, a term deprecated in physics and engineering as well as in chemistry. Relative permittivity is typically denoted as εr and is defined as ε r = ε ε0, where ε is the complex frequency-dependent absolute permittivity of the material, and ε0 is the vacuum permittivity. Relative permittivity is a number that is in general complex-valued, its real and imaginary parts are denoted as. The relative permittivity of a medium is related to its electric susceptibility, χe, in anisotropic media the relative permittivity is a second rank tensor. The relative permittivity of a material for a frequency of zero is known as its relative permittivity. The historical term for the relative permittivity is dielectric constant and it is still commonly used, but has been deprecated by standards organizations, because of its ambiguity, as some older authors used it for the absolute permittivity ε. The permittivity may be quoted either as a property or as a frequency-dependent variant. It has also used to refer to only the real component εr of the complex-valued relative permittivity. In the causal theory of waves, permittivity is a complex quantity, the imaginary part corresponds to a phase shift of the polarization P relative to E and leads to the attenuation of electromagnetic waves passing through the medium. By definition, the relative permittivity of vacuum is equal to 1. The relative static permittivity, εr, can be measured for static electric fields as follows, first the capacitance of a test capacitor, then, using the same capacitor and distance between its plates, the capacitance Cx with a dielectric between the plates is measured. The relative dielectric constant can be calculated as ε r = C x C0. For time-variant electromagnetic fields, this quantity becomes frequency-dependent, an indirect technique to calculate εr is conversion of radio frequency S-parameter measurement results. A description of frequently used S-parameter conversions for determination of the frequency-dependent εr of dielectrics can be found in this bibliographic source, alternatively, resonance based effects may be employed at fixed frequencies. The relative permittivity is a piece of information when designing capacitors wikivisually.com титанат кальция - это... Что такое титанат кальция? титанат кальция nchem. Kalziumtitanat Универсальный русско-немецкий словарь. Академик.ру. 2011.
Смотреть что такое "титанат кальция" в других словарях:
universal_ru_de.academic.ru Титанат кальциятитанат кальция хлорид, титанат кальция глюконатТитанат кальция — соединение с химической формулой CaTiO3. Как минерал известен под названием перовскит (назван в честь русского минералога Л. А. Перовского (1792—1856)).Первоначально кристаллическая структура перовскита считалась кубической, что послужило основанием для введения структурного типа перовскита, в котором кристаллизуются несколько сотен химических соединений. Позже было выяснено, что структура CaTiO3 немного искажена относительно кубической (при комнатной температуре она является орторомбической, пространственная группа Pnma), а кубическую структуру титанат кальция приобретает только при температуре выше 1260—1300 °C в результате фазового перехода. Титанат кальция является диэлектриком с достаточно высокой диэлектрической проницаемостью (ε ~ 170 при комнатной температуре). Поэтому керамические материалы на его основе используются для изготовления конденсаторов. ПолучениеТитанат кальция получают спеканием CaCO3 с TiO2 при 1100—1200 °C. Литература
титанат кальция глицерофосфат, титанат кальция глюконат, титанат кальция гопантенат, титанат кальция хлорид Титанат кальция Информация о
Титанат кальция КомментарииТитанат кальцияТитанат кальция Титанат кальция Просмотр темы. Титанат кальция что, Титанат кальция кто, Титанат кальция объяснение There are excerpts from wikipedia on this article and video www.turkaramamotoru.com | ||||||
|
||||||||||||||||||
|
|
||||||||||||||||||
|