Жидкий водород: свойства и применение. Жидкий водородЖидкий водород: свойства и применениеЖидкий водород – одно из агрегатных состояний водорода. Выделяют еще газообразное и твердое состояние этого элемента. И если газообразная форма хорошо знакома многим, то остальные два крайних состояния вызывают вопросы.
ИсторияЖидкий водород был получен только в тридцатых годах прошлого века, но до этого химия прошла долгий путь по освоению такого способа хранения газов и применения. Искусственное охлаждение экспериментально начали применять в середине восемнадцатого века в Англии. В 1984 году получили сжиженный диоксид серы и аммиак. На основе этих исследований через двадцать лет был разработан первый холодильник, а еще через тридцать лет Перкинс оформил официальный патент на свое изобретение. В 1851 году по другую сторону Атлантического океана Джон Гори заявил о правах на создание кондиционера. До водорода дело дошло только в 1885 году, когда поляк Вроблевский анонсировал в своей статье тот факт, что точка кипения этого элемента равна 23 Кельвинам, пик температуры – 33 Кельвинам, а критическое давление равно 13 атмосферам. После этого заявления создать жидкий водород попытался Джеймс Дьюар в конце 19-го века, но стабильной субстанции у него не получилось. Физические свойстваДанное агрегатное состояние характеризуется очень низкой плотностью вещества – сотые доли граммов на кубический сантиметр. Это дает возможность использовать относительно маленькие емкости, чтобы хранить жидкий водород. Температура кипения равна всего 20 Кельвинам (-252 по Цельсию), а замерзает эта субстанция уже при 14 Кельвинах.
Жидкость не имеет запаха, цвета и вкуса. Смешивание ее с кислородом может привести к взрыву в половине случаев. При достижении температуры кипения водород переходит в газообразное состояние, и его объем увеличивается в 850 раз. После сжижения водород помещается в изолированные контейнеры, в которых поддерживается низкое давление и температура в промежутке от 15 до 19 Кельвинов. Распространенность водородаЖидкий водород производится искусственно и в естественной среде не встречается. Если не брать в расчет агрегатные состояния, то водород – самый распространенный элемент не только на планете Земля, но и во Вселенной. Из него состоят звезды (в том числе и наше Солнце), им заполнено пространство между ними. Водород принимает участие в реакциях термоядерного синтеза, а также может образовывать облака. В земной коре этот элемент занимает всего лишь около процента от всего количества вещества. Его роль в нашей экосистеме можно оценить по тому факту, что число атомов водорода по количеству уступает только кислороду. На нашей планете практически все запасы Н2 находятся в связанном состоянии. Водород - составная часть всех живых существ. ИспользованиеЖидкий водород (температура по Цельсию -252 градуса) используется в виде формы для хранения бензина и других производных нефтепереработки. Кроме того, в данный момент создаются концепции транспорта, который смог бы использовать сжиженный водород как топливо вместо природного газа. Это позволило бы сократить затраты на добычу ценных ископаемых и снизить выбросы в атмосферу. Но пока оптимальной конструкции двигателя так и не было найдено. Жидкий водород активно используется физиками как охладитель в их экспериментах с нейтронами. Так как масса элементарной частицы и ядра водорода практически равны, обмен энергией между ними является весьма эффективным. Преимущества и препятствияЖидкий водород дает возможность замедлить нагревание атмосферы и уменьшить количество парниковых газов, если применять его в качестве топлива для автомобилей. При его взаимодействии с воздухом (после прохождения через двигатель внутреннего сгорания) будет образовываться вода и незначительно количество оксида азота.
Однако у этой идеи есть и свои трудности, например, способ хранения и транспортировки газа, а также повышенная опасность воспламенения или даже взрыва. Даже при условии соблюдения всех мер предосторожности предотвратить испарение водорода не удается. Ракетное топливоЖидкий водород (температура хранения до 20 Кельвинов) является одним из компонентов ракетного топлива. У него есть несколько функций:
Современные ракетные двигатели работают на комбинации водород-кислород. Это помогает достичь нужной скорости для преодоления притяжения земли и при этом сохранить все части летательных аппаратов, не подвергая их действию чрезмерных температур.
На данный момент существует только одна ракета, которая полностью использует водород в качестве топлива. В большинстве случаев жидкий водород необходим для отделения верхних ступеней ракет или в тех аппаратах, которые большую часть работы проведут в вакууме. От исследователей поступали предложения использовать наполовину замороженную форму этого элемента, чтобы повысить его плотность. fb.ru Жидкий водород - это... Что такое Жидкий водород?«Жи́дкий водоро́д» («ЖВ») — жидкое агрегатное состояние водорода, с низкой удельной плотностью 0.07 г/см³ и криогенными свойствами с точкой замерзания 14.01 K (−259.14 °C) и точкой кипения 20.28 K (−252.87 °C)[1]. Является бесцветной жидкостью без запаха, которая при смешивании с воздухом относится к взрывоопасным веществам с диапазоном коэффициента воспламенения 4-75 %. Спиновое соотношение изомеров в жидком водороде составляет: 99,79 % — параводород; 0,21 % — ортоводород[2]. Коэффициент расширения водорода при смене агрегатного состояния на газообразное составляет 848:1 при 20 °C.Как и для любого другого газа, сжижение водорода приводит к уменьшению его объема. После сжижения жидкий водород хранится в термически изолированных контейнерах под давлением. Жидкий водород (англ. Liquid hydrogen, Lh3, Lh3) активно используется в промышленности, в качестве формы хранения газа, и в космической отрасли, в качестве ракетного топлива. ИсторияПервое документированное использование искусственного охлаждения в 1756 году было осуществлено английским ученым Вильямом Калленом[3], Гаспар Монж первым получил жидкое состояние оксида серы в 1784 году, Майкл Фарадей первым получил сжиженный аммиак, американский изобретатель Оливер Эванс первым разработал холодильный компрессор в 1805 году, Яков Перкинс первым запатентовал охлаждающую машину в 1834 году и Джон Гори первым в США запатентовал кондиционер в 1851 году[4][5], Вернер Сименс предложил концепцию регенеративного охлаждения в 1857 году, Карл Линде запатентовал оборудование для получения жидкого воздуха с использованием каскадного «эффекта расширения Джоуля — Томсона» и регенеративного охлаждения[6] в 1876 году. В 1885 году польский физик и химик Зигмунд Вро́блевский опубликовал критическую температуру водорода 33 K, критическое давление 13.3 атм. и точку кипения при 23 K. Впервые водород был сжижен Джеймсом Дьюаром в 1898 году с использованием регенеративного охлаждения и своего изобретения, cосуда Дьюара. Первый синтез стабильного изомера жидкого водорода — параводорода — был осуществлен Полом Хартеком и Карлом Бонхеффером в 1929 году. Спиновые изомеры водородаВодород при комнатной температуре состоит на 75 % из спинового изомера, ортоводорода. После производства жидкий водород находится в метастабильном состоянии и должен быть преобразован в параводородную форму, для того чтобы избежать спонтанной экзотермической реакции его превращения, приводящей к сильному самопроизвольному испарению полученного жидкого водорода. Преобразование в параводородную фазу обычно производится с использованием таких катализаторов, как оксид железа, оксид хрома, активированный уголь, покрытых платиной асбестов, редкоземельных металлов или путем использования урановых или никелевых добавок[7]. ИспользованиеЖидкий водород может быть использован в качестве формы хранения топлива для двигателей внутреннего сгорания и топливных элементов. Различные концепты водородного транспорта были созданы с использованием этой агрегатной формы водорода (см. например «DeepC» или «BMW h3R»). Благодаря близости конструкций, создатели техники на «ЖВ» могут использовать или только модифицировать системы, использующие сжиженный природный газ («СПГ»). Однако из-за более низкой объемной плотности энергии для горения требуется больший объем водорода, чем природного газа. Если жидкий водород используется вместо «СПГ» в поршневых двигателях, обычно требуется более громоздкая топливная система. При прямом впрыске увеличившиеся потери во впускном тракте уменьшают наполнение цилиндров. Жидкий водород используется также для охлаждения нейтронов в экспериментах по нейтронному рассеянию. Массы нейтрона и ядра водорода практически равны, поэтому обмен энергией при упругом столкновении наиболее эффективен. ПреимуществаПреимуществом использования водорода является «нулевая эмиссия» его применения. Продуктом его взаимодействия с кислородом в воздухе является вода, но в реальности — как и в случае с обычными ископаемыми энергоносителями — из-за наличия в воздухе молекул азота при его горении образуется также незначительное количество оксидов этого газа. ПрепятствияОдин литр «ЖВ» весит всего 0.07 кг. То есть его удельная плотность составляет 70.99 г/л при 20 K. Жидкий водород требует криогенной технологии хранения, такой как специальные термически изолированные контейнеры и требует особого обращения, что свойственно для всех криогенных материалов. Он близок в этом отношении к жидкому кислороду, но требует большей осторожности из-за пожароопасности. Даже в случае с контейнерами с тепловой изоляцией, его тяжело содержать при той низкой температуре, которая требуется для его сохранения в жидком состоянии (обычно он испаряется со скоростью 1 % в день[8]). При обращении с ним также нужно следовать обычным мерам безопасности при работе с водородом[9] — он достаточно холоден для сжижения воздуха, что взрывоопасно. Ракетное топливоЖидкий водород является распространенным компонентом ракетных топлив, которое используется для реактивного ускорения ракет-носителей и космических аппаратов. В большинстве жидкостных ракетных двигателях на водороде, он сначала применяется для регенеративного охлаждения сопла и других частей двигателя, перед его смешиванием с окислителем и сжиганием для получения тяги. Используемые современные двигатели на компонентах h3/O2 потребляют переобогащенную водородом топливную смесь, что приводит к некоторому количеству несгоревшего водорода в выхлопе. Кроме увеличения удельного импульса двигателя за счет уменьшения молекулярного веса, это еще сокращает эрозию сопла и камеры сгорания. Такие препятствия использования «ЖВ» в других областях, как криогенная природа и малая плотность, являются также сдерживающим фактором для использования в данном случае. На 2009 год существует только одна ракета-носитель (РН «Дельта-4»), которая целиком является водородной ракетой. В основном «ЖВ» используется либо на верхних ступенях ракет, либо на блоках, которые значительную часть работы по выводу полезной нагрузки в космос выполняют в вакууме. В качестве одной из мер по увеличению плотности этого вида топлива существуют предложения использования шугообразного водорода, то есть полузамерзшей формы «ЖВ». Водород с разными окислителямиДанные приводятся на основании[10] таблиц, опубликованных в США в рамках проекта сбора термодинамических данных «JANAF» (англ. Joint Army Navy Air Force, «Сборник ВМС и ВВС армии США»), которые широко используются в этих целях. Изначально вычисления производились компанией «Рокетдайн».[11] При этом делались предположения, что имеет место адиабатическое сгорание, изоэнтропийное расширение в одном направлении и имеет место смещение равновесного состояния. Кроме варианта использования водорода в качестве топлива, приводятся варианты с использованием водорода в качестве рабочего тела, что объясняется его небольшим молекулярным весом. Все данные рассчитаны для давления в камере сгорания («КС»), равного 68,05 атмосферы. Последняя строка таблицы содержит данные для газообразных водорода и кислорода.
при этом «Ve» является той же единицей, что и удельный импульс, но приведена к размерности скорости [Н*сек/кг], а «C*» вычисляется путем умножения давления в камере сгорания на коэффициент расширения площади сопла и последующего деления на массовый расход топлива и окислителя, что дает приращение скорости на единицу массы. См. такжеОпасностьЖидкий водород довольно опасен для человека. Попадание LH на кожу может вызвать обморожение, а вдыхание паров привести к отёку легких. Примечания
Ссылкиdic.academic.ru Жидкий водород | Наука | FANDOM powered by WikiaВ последние десятилетия часто обсуждаются различные возможности использования водорода в качестве энергоносителя. В пользу водорода, как универсального энергоносителя говорят многие обстоятельства: 1. Для получения водорода может использоваться вода, запасы которой на сегодняшний день представляются значительными. 2. Продукты горения водорода значительно более экологически чистые, чем у бензина и дизельного топлива. 3. Водород может использоваться в существующих двигателях при их небольшой конструктивной доработке. 4. У водорода высокая удельная теплота сгорания; хорошая воспламеняемость водородовоздушной смеси в широком диапазоне температур; высокая антидетонационная стойкость, допускающая работу при степени сжатия до 14; высокая скорость и полнота сгорания. Практическое использование водорода наталкивается на ряд существенных трудностей, обусловленных в первую очередь с повышенной взрывоопасностью рабочего тела. Проблемы безопасности в водородной технологии связаны с горением водорода, с его криогенным состоянием, коррозионной стойкостью и снижением прочностных свойств материалов при низких температурах, высокой текучестью и проникающей способностью. Все это требует тщательного соблюдения требований техники безопасности при работе с водородом. Для обеспечения минимальной опасности при обращении с водородом необходимо соблюдение следующих условий: 1. Широкое ознакомление персонала с особенностями водорода как химического продукта. 2. Постоянное повышение надежности средств и способов обеспечения безопасности при выполнении различных технологических операций с водородом. 3. Создание надежных средств индикации утечек водорода. Токсические свойства и физиологическое воздействие водорода на человекаПравитьВследствие низкой температуры кипения жидкий водород при попадании на слабо защищенные или открытые участки тела может вызвать сильные ожоги. Ожоги глаз и кожи может вызвать также и холодный газообразный водород. Обмораживание жидким и холодным газообразным водородом происходит не мгновенно. Холодный газ – плохой проводник тепла, поэтому имеется некоторый интервал времени, когда удается принять эффективные меры против обмораживания. Согревание пораженного участка следует производить водой не горячее 44?С. Обмороженный участок тела не следует растирать. Кроме общих средств защиты при работе с водородом применяют и индивидуальные. Руки работающих с жидким водородом должны быть защищены асбестовыми или кожаными рукавицами; на ноги следует надевать высокие ботинки с отворотами, газа и лицо должны быть защищены очками с щитками или прозрачными экранами. Пожаро- и взрывоопасность водорода.ПравитьСовершенно недопустимо попадание воздуха (кислорода) в емкости и трубопроводы, заполненные жидким водородом. Воздух замерзает и осаждается на стенках выше уровня жидкости водорода или опускается на дно емкости. Ломающиеся кристаллы кислорода или твердого воздуха могут являться источником воспламенения или взрыва. по этой причине азот, которым продуваются магистрали и емкости перед заполнением их водородом, должен содержать не более 0,5-1% кислорода. Разлитый жидкий водород представляет опасность, т.к. он быстро испаряется, образуя пожаро- и взрывоопасные смеси. Водородное пламя почти невидимо при дневном свете. В связи с этим необходимо использовать датчики для его детектирование. Наиболее распространенные оптические датчики детектируют ультрафиолетовые и инфракрасное излучение. Вздувающиеся краски также успешно используют для этой цели. Эти краски обугливаются и набухают при сравнительно низкой температуре (около 470К) и выделяют едкие газы. Меры безопасности при обращении с жидким водородом должны исключать возможность неконтролируемой его утечки, а также обеспечивать быструю эвакуацию просочившегося газа. Для сооружений, расположенных на открытых площадках, хранилищ жидкого водорода, могут быть рекомендованы следующие мероприятия: 1. В зоне проведения работ с жидким водородом необходимо иметь водяной душ, брандспойт или специальный резервуар с водой для смывания жидкого продукта с обрызганных участков технологического оборудования. 2. Резервуары и цистерны для хранения жидкого продукта следует периодически с интервалом в 1-2 года очищать от твердых отложений (кислород, азот и т.п.) путем их размораживания. 3. Необходима тщательная проверка технологического оборудования на герметичность. Признаком утечки водорода из хранилища является образование инея на деталях оборудования. 4. Защитные стены нельзя сооружать около резервуаров хранилищ. Для хорошей циркуляции газов резервуары следует устанавливать таким образом, чтобы они были открыты для доступа воздуха с возможно большего числа сторон. 5. Зона возможной опасности вокруг резервуара в соответствии с инструкцией по технике безопасности должна быть обозначена. ru.science.wikia.com Жидкий водород — WiKiЖи́дкий водоро́д (ЖВ) — жидкое агрегатное состояние водорода, с низкой плотностью − 0,07 г/см³, и криогенными свойствами с точкой замерзания 14,01 K (−259,14 °C) и точкой кипения 20,28 K (−252,87 °C)[1]. Является бесцветной жидкостью без запаха, которая при смешивании с воздухом относится к взрывоопасным веществам с диапазоном коэффициента воспламенения 4—75 %. Спиновое соотношение изомеров в жидком водороде[en] составляет: 99,79 % — параводород; 0,21 % — ортоводород[2]. Коэффициент расширения[en] водорода при смене агрегатного состояния на газообразное при комнатной температуре составляет 848:1. Как и для любого другого газа, сжижение водорода приводит к уменьшению его объёма. После сжижения жидкий водород хранится в термически изолированных контейнерах под давлением. Жидкий водород (англ. Liquid hydrogen, Lh3, Lh3) активно используется в промышленности (в качестве формы хранения газа), и в космонавтике (в качестве ракетного топлива). ИсторияСпиновые изомеры водородаИспользованиеЖидкий водород может быть использован в качестве формы хранения топлива для двигателей внутреннего сгорания и топливных элементов. Различные концепты водородного транспорта были созданы с использованием этой агрегатной формы водорода (см. например DeepC[en] или BMW h3R[en]). Благодаря близости конструкций, создатели техники на «ЖВ» могут использовать или только модифицировать системы, использующие сжиженный природный газ («СПГ»). Однако из-за более низкой объёмной плотности энергии для горения требуется больший объём водорода, чем природного газа. Если жидкий водород используется вместо «СПГ» в поршневых двигателях, обычно требуется более громоздкая топливная система. При прямом впрыске увеличившиеся потери во впускном тракте уменьшают наполнение цилиндров. Жидкий водород используется также для охлаждения нейтронов в экспериментах по нейтронному рассеянию. Массы нейтрона и ядра водорода практически равны, поэтому обмен энергией при упругом столкновении наиболее эффективен. ПреимуществаПреимуществом использования водорода является «нулевая эмиссия» его применения. Продуктом его взаимодействия с кислородом в воздухе является вода, но в реальности — как и в случае с обычными ископаемыми энергоносителями — из-за наличия в воздухе молекул азота при его горении образуется также незначительное количество оксидов этого газа. ПрепятствияОдин литр «ЖВ» весит всего 0,07 кг. То есть его удельная плотность составляет 70,99 г/л при 20 K. Жидкий водород требует криогенной технологии хранения, такой как специальные термически изолированные контейнеры и требует особого обращения, что свойственно для всех криогенных материалов. Он близок в этом отношении к жидкому кислороду, но требует большей осторожности из-за пожароопасности. Даже в случае с контейнерами с тепловой изоляцией его тяжело содержать при той низкой температуре, которая требуется для его сохранения в жидком состоянии (обычно он испаряется со скоростью 1 % в день[8]). При обращении с ним также нужно следовать обычным мерам безопасности при работе с водородом («Водородная безопасность») — он достаточно холоден для сжижения воздуха, что взрывоопасно. Ракетное топливоЖидкий водород является распространенным компонентом ракетного топлива, которое используется для реактивного ускорения ракет-носителей и космических аппаратов. В большинстве жидкостных ракетных двигателей на водороде, он сначала применяется для регенеративного охлаждения сопла и других частей двигателя, перед его смешиванием с окислителем и сжиганием для получения тяги. Используемые современные двигатели на компонентах h3/O2 потребляют переобогащенную водородом топливную смесь, что приводит к некоторому количеству несгоревшего водорода в выхлопе. Кроме увеличения удельного импульса двигателя за счет уменьшения молекулярного веса, это ещё сокращает эрозию сопла и камеры сгорания. Такие препятствия использования ЖВ в других областях, как криогенная природа и малая плотность, являются также сдерживающим фактором для использования в данном случае. На 2009 год существует только одна ракета-носитель («Дельта-4»), которая целиком является водородной ракетой. В основном ЖВ используется либо на верхних ступенях ракет, либо на блоках, которые значительную часть работы по выводу полезной нагрузки в космос выполняют в вакууме. В качестве одной из мер по увеличению плотности этого вида топлива существуют предложения использования шугообразного водорода, то есть полузамерзшей формы ЖВ. Водород с разными окислителямиДанные приводятся на основании[9] таблиц, опубликованных в США в рамках проекта сбора термодинамических данных «JANAF» (англ. Joint Army Navy Air Force, «Сборник ВМС и ВВС армии США»), которые широко используются в этих целях. Изначально вычисления производились компанией «Рокетдайн».[10] При этом делались предположения, что имеет место адиабатическое сгорание, изоэнтропийное расширение в одном направлении и имеет место смещение равновесного состояния. Кроме варианта использования водорода в качестве топлива, приводятся варианты с использованием водорода в качестве рабочего тела, что объясняется его небольшим молекулярным весом. Все данные рассчитаны для давления в камере сгорания («КС»), равного 68,05 атмосферы. Последняя строка таблицы содержит данные для газообразных водорода и кислорода.
при этом «Ve» является той же единицей, что и удельный импульс, но приведена к размерности скорости [Н*сек/кг], а «C*» вычисляется путём умножения давления в камере сгорания на коэффициент расширения площади сопла и последующего деления на массовый расход топлива и окислителя, что дает приращение скорости на единицу массы. ОпасностьЖидкий водород довольно опасен для человека. Попадание LH на кожу может вызвать обморожение, а вдыхание паров привести к отёку легких. См. такжеПримечания
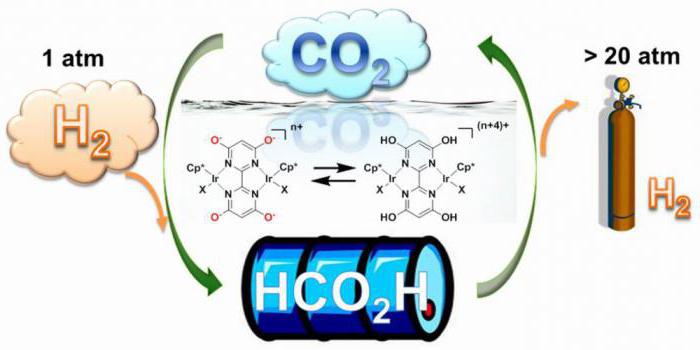
Ссылкиru-wiki.org Жидкий водород ВикипедияЖи́дкий водоро́д (ЖВ) — жидкое агрегатное состояние водорода, с низкой плотностью − 0,07 г/см³, и криогенными свойствами с точкой замерзания 14,01 K (−259,14 °C) и точкой кипения 20,28 K (−252,87 °C)[1]. Является бесцветной жидкостью без запаха, которая при смешивании с воздухом относится к взрывоопасным веществам с диапазоном коэффициента воспламенения 4—75 %. Спиновое соотношение изомеров в жидком водороде[en] составляет: 99,79 % — параводород; 0,21 % — ортоводород[2]. Коэффициент расширения[en] водорода при смене агрегатного состояния на газообразное при комнатной температуре составляет 848:1. Как и для любого другого газа, сжижение водорода приводит к уменьшению его объёма. После сжижения жидкий водород хранится в термически изолированных контейнерах под давлением. Жидкий водород (англ. Liquid hydrogen, Lh3, Lh3) активно используется в промышленности (в качестве формы хранения газа), и в космонавтике (в качестве ракетного топлива). История[ | код]Первое документированное использование искусственного охлаждения в 1756 году было осуществлено английским ученым Вильямом Калленом[3], Гаспар Монж первым получил жидкое состояние оксида серы в 1784 году, Майкл Фарадей первым получил сжиженный аммиак, американский изобретатель Оливер Эванс первым разработал холодильный компрессор в 1805 году, Яков Перкинс первым запатентовал охлаждающую машину в 1834 году и Джон Гори первым в США запатентовал кондиционер в 1851 году[4][5], Вернер Сименс предложил концепцию регенеративного охлаждения в 1857 году, Карл Линде запатентовал оборудование для получения жидкого воздуха с использованием каскадного «эффекта расширения Джоуля — Томсона» и регенеративного охлаждения[6] в 1876 году. В 1885 году польский физик и химик Зигмунд Вро́блевский опубликовал критическую температуру водорода 33 K, критическое давление 13.3 атм. и точку кипения при 23 K. Впервые водород был сжижен Джеймсом Дьюаром в 1898 году с использованием регенеративного охлаждения и своего изобретения, сосуда Дьюара. Первый синтез стабильного изомера жидкого водорода — параводорода — был осуществлен Полом Хартеком и Карлом Бонхеффером в 1929 году. Спиновые изомеры водорода[ | код]Водород при комнатной температуре состоит на 75 % из спинового изомера, ортоводорода. После производства жидки ru-wiki.ru Жидкий водород при комнатной температуреСоздано 23.03.2012 16:02 Автор: Александр КомпанеецУченым удалось разработать катализатор, который позволяет хранить и транспортировать водород в жидкой форме в естественных температурных режимах. Недавно представители Департамента Энергетики Национальной лаборатории Брукхевена объявили об удачном завершении ряда экспериментов, которые могут открыть дорогу чистому голубому топливу на массовые рынки. Рецепт чудо материала, конечно, не раскрывается. Известно только, что в качестве катализатора используется вещество, содержащее иридий. Катализатор эффективно аккумулирует и высвобождает водород из муравьиной кислоты, которая обычно используется как консервант или антибактериальное средство. В присутствии этого катализатора, газообразная смесь водорода и углекислого газа образует муравьиную кислоту. В таком виде плотность хранения водорода превышает плотность «упаковки» при его хранении в газообразной форме, что до сих пор было основным препятствием для использования водорода в массовых секторах экономики и энергетики. Более того, такой способ хранения «голубого топлива», делает топливный резервуар более безопасным в плане пожароустойчивости. Напомним, что водород – это один из самых перспективных видов топлива, который готов прийти на смену ископаемому углеводородному топливу. Водород – один из самых распространенных элементов во Вселенной, его много на нашей планете, при сгорании получается чистый водяной пар – практически идеальный вид топлива. «Это далеко не первый вид катализатора, который способствует описанным выше процессам, но это первый из них, работающий при комнатной температуре и при естественном атмосферном давлении. Новый катализатор позволяет производить реакцию в обе стороны, что позволяет использовать один универсальный метод как для накопления, так и для извлечения топлива», - сказал в интервью Этсуко Фуджита (Etsuko Fujita). Новая технология позволит не только безопасно хранить и транспортировать водородное топливо, но также и не выделяет угарный газ, который может разрушать или сокращать срок службы водородных топливных элементов. На следующем шаге исследований, ученые попытаются оптимизировать технологию хранения водорода, сделав ее пригодной для коммерческого использования. И возможно, мы еще застанем то время, когда автомобили, питающиеся нефтепродуктами, будут восприниматься, как пережитки прошлого.
www.facepla.net Жидкий водород ВикипедияЖи́дкий водоро́д (ЖВ) — жидкое агрегатное состояние водорода, с низкой плотностью − 0,07 г/см³, и криогенными свойствами с точкой замерзания 14,01 K (−259,14 °C) и точкой кипения 20,28 K (−252,87 °C)[1]. Является бесцветной жидкостью без запаха, которая при смешивании с воздухом относится к взрывоопасным веществам с диапазоном коэффициента воспламенения 4—75 %. Спиновое соотношение изомеров в жидком водороде[en] составляет: 99,79 % — параводород; 0,21 % — ортоводород[2]. Коэффициент расширения[en] водорода при смене агрегатного состояния на газообразное при комнатной температуре составляет 848:1. Как и для любого другого газа, сжижение водорода приводит к уменьшению его объёма. После сжижения жидкий водород хранится в термически изолированных контейнерах под давлением. Жидкий водород (англ. Liquid hydrogen, Lh3, Lh3) активно используется в промышленности (в качестве формы хранения газа), и в космонавтике (в качестве ракетного топлива). ИсторияПервое документированное использование искусственного охлаждения в 1756 году было осуществлено английским ученым Вильямом Калленом[3], Гаспар Монж первым получил жидкое состояние оксида серы в 1784 году, Майкл Фарадей первым получил сжиженный аммиак, американский изобретатель Оливер Эванс первым разработал холодильный компрессор в 1805 году, Яков Перкинс первым запатентовал охлаждающую машину в 1834 году и Джон Гори первым в США запатентовал кондиционер в 1851 году[4][5], Вернер Сименс предложил концепцию регенеративного охлаждения в 1857 году, Карл Линде запатентовал оборудование для получения жидкого воздуха с использованием каскадного «эффекта расширения Джоуля — Томсона» и регенеративного охлаждения[6] в 1876 году. В 1885 году польский физик и химик Зигмунд Вро́блевский опубликовал критическую температуру водорода 33 K, критическое давление 13.3 атм. и точку кипения при 23 K. Впервые водород был сжижен Джеймсом Дьюаром в 1898 году с использованием регенеративного охлаждения и своего изобретения, сосуда Дьюара. Первый синтез стабильного изомера жидкого водорода — параводорода — был осуществлен Полом Хартеком и Карлом Бонхеффером в 1929 году. Спиновые изомеры водородаВодород при комнатной температуре состоит на 75 % из спинового изомера, ортоводорода. После производства жидкий водород находится в метастабильном состоянии и должен быть преобразован в параводородную форму, для того чтобы избежать спонтанной экзотермической реакции его превращения, приводящей к сильному самопроизвольному испарению полученного жидкого водорода. Преобразование в параводородную фазу обычно производится с использованием таких катализаторов, как оксид железа, оксид хрома, активированный уголь, покрытых платиной асбестов, редкоземельных металлов или путём использования урановых или никелевых добавок[7]. ИспользованиеЖидкий водород может быть использован в качестве формы хранения топлива для двигателей внутреннего сгорания и топливных элементов. Различные концепты водородного транспорта были созданы с использованием этой агрегатной формы водорода (см. например DeepC[en] или BMW h3R[en]). Благодаря близости конструкций, создатели техники на «ЖВ» могут использовать или только модифицировать системы, использующие сжиженный природный газ («СПГ»). Однако из-за более низкой объёмной плотности энергии для горения требуется больший объём водорода, чем природного газа. Если жидкий водород используется вместо «СПГ» в поршневых двигателях, обычно требуется более громоздкая топливная система. При прямом впрыске увеличившиеся потери во впускном тракте уменьшают наполнение цилиндров. Жидкий водород используется также для охлаждения нейтронов в экспериментах по нейтронному рассеянию. Массы нейтрона и ядра водорода практически равны, поэтому обмен энергией при упругом столкновении наиболее эффективен. ПреимуществаПреимуществом использования водорода является «нулевая эмиссия» его применения. Продуктом его взаимодействия с кислородом в воздухе является вода, но в реальности — как и в случае с обычными ископаемыми энергоносителями — из-за наличия в воздухе молекул азота при его горении образуется также незначительное количество оксидов этого газа. ПрепятствияОдин литр «ЖВ» весит всего 0,07 кг. То есть его удельная плотность составляет 70,99 г/л при 20 K. Жидкий водород требует криогенной технологии хранения, такой как специальные термически изолированные контейнеры и требует особого обращения, что свойственно для всех криогенных материалов. Он близок в этом отношении к жидкому кислороду, но требует большей осторожности из-за пожароопасности. Даже в случае с контейнерами с тепловой изоляцией его тяжело содержать при той низкой температуре, которая требуется для его сохранения в жидком состоянии (обычно он испаряется со скоростью 1 % в день[8]). При обращении с ним также нужно следовать обычным мерам безопасности при работе с водородом («Водородная безопасность») — он достаточно холоден для сжижения воздуха, что взрывоопасно. Ракетное топливоЖидкий водород является распространенным компонентом ракетного топлива, которое используется для реактивного ускорения ракет-носителей и космических аппаратов. В большинстве жидкостных ракетных двигателей на водороде, он сначала применяется для регенеративного охлаждения сопла и других частей двигателя, перед его смешиванием с окислителем и сжиганием для получения тяги. Используемые современные двигатели на компонентах h3/O2 потребляют переобогащенную водородом топливную смесь, что приводит к некоторому количеству несгоревшего водорода в выхлопе. Кроме увеличения удельного импульса двигателя за счет уменьшения молекулярного веса, это ещё сокращает эрозию сопла и камеры сгорания. Такие препятствия использования ЖВ в других областях, как криогенная природа и малая плотность, являются также сдерживающим фактором для использования в данном случае. На 2009 год существует только одна ракета-носитель («Дельта-4»), которая целиком является водородной ракетой. В основном ЖВ используется либо на верхних ступенях ракет, либо на блоках, которые значительную часть работы по выводу полезной нагрузки в космос выполняют в вакууме. В качестве одной из мер по увеличению плотности этого вида топлива существуют предложения использования шугообразного водорода, то есть полузамерзшей формы ЖВ. Водород с разными окислителямиДанные приводятся на основании[9] таблиц, опубликованных в США в рамках проекта сбора термодинамических данных «JANAF» (англ. Joint Army Navy Air Force, «Сборник ВМС и ВВС армии США»), которые широко используются в этих целях. Изначально вычисления производились компанией «Рокетдайн».[10] При этом делались предположения, что имеет место адиабатическое сгорание, изоэнтропийное расширение в одном направлении и имеет место смещение равновесного состояния. Кроме варианта использования водорода в качестве топлива, приводятся варианты с использованием водорода в качестве рабочего тела, что объясняется его небольшим молекулярным весом. Все данные рассчитаны для давления в камере сгорания («КС»), равного 68,05 атмосферы. Последняя строка таблицы содержит данные для газообразных водорода и кислорода.
при этом «Ve» является той же единицей, что и удельный импульс, но приведена к размерности скорости [Н*сек/кг], а «C*» вычисляется путём умножения давления в камере сгорания на коэффициент расширения площади сопла и последующего деления на массовый расход топлива и окислителя, что дает приращение скорости на единицу массы. ОпасностьЖидкий водород довольно опасен для человека. Попадание LH на кожу может вызвать обморожение, а вдыхание паров привести к отёку легких. См. такжеПримечания
Ссылкиwikiredia.ru |
|
|||||||||||||||||
|
|
|||||||||||||||||
|