Ортофосфорная кислота для пайки. Ортофосфорная кислота свойстваОртофосфорная кислота - свойства, применениеОртофосфорной кислотой называется неорганическое соединение. Как кислота она довольно слабая. В производстве пищевых продуктов применяется как регулятор кислотности, ее маркировка – Е338. В чистом виде ортофосфорная кислота имеет вид гигроскопичных кристаллов без цвета. Одно из свойств ортофосфорной кислоты заключается в следующем: при температуре, превышающей 42 градуса по Цельсию, начинается процесс ее плавления, при этом вещество превращается в вязкую жидкость без цвета. Еще одним свойством ортофосфорной кислоты является то, что она отлично растворяется в воде. В связи с этим кислота применяется зачастую в качестве 85% водного раствора. В данном виде вещество представляет собой сиропообразную жидкость без цвета. Кислота обладает хорошей степенью растворимости во многих растворителях, а также не имеет запаха. С чем проходит взаимодействие ортофосфорной кислоты? Основные оксиды, металлы, основания, соли слабых кислот, аммиак – это вещества, с которыми происходит взаимодействие ортофосфорной кислоты. Ортофосфорная кислота: применениеШирокое применение ортофосфорная кислота нашла в производстве пищевых продуктов как добавка Е338, а также в пайке как флюс, в проведении исследований в сфере молекулярной биологии. Основным потребителем кислоты служит сфера по производству комбинированных и фосфорных удобрений: фосфорных солей натрия, аммония, кальция, алюминия, марганца. Применяется она и во время производства кинопленки, активированного угля, для органического синтеза, в производстве огнеупорных связующих, самих огнеупоров, стекла, керамики, моющих средств синтетического происхождения, в металлообрабатывающей промышленности с целью полировки и очистки поверхности металлов. Применение ортофосфорная кислота нашла в спичечной промышленности, в текстильной с целью выработки тканей с пропиткой против огня, для производства пищевой и реактивной фосфорной кислоты. Добавка Е338 принадлежит группе антиоксидантов, то есть веществ, которые предотвращают изменение цвета и окисление продуктов питания. Кислота используется с целью подкисления напитков, пищи. Она дает кислый или острый привкус. Ортофосфорная кислота широко применяется при изготовлении плавленых сырков, сахара, колбас, хлебопекарных порошков, ароматизированных напитков из-за легкости получения и низкой стоимости. Еще одной областью применения ортофосфорной кислоты является сельское хозяйство: в звероводстве используется выпойка раствором кислоты с целью профилактики мочекаменной болезни и повышенной рН желудка. Ортофосфорная кислота: вред или польза?Ортофосфорная кислота считается безопасной добавкой к пище, если соблюдены предельно-допустимые нормы ее потребления. Однако, как говорят некоторые проведенные исследования, напитки с Е338 могут привести к понижению степени плотности костной ткани. Однако этот факт другие исследователи не подтверждают. Некоторые врачи-стоматологи обнаружили закономерность в потреблении сладких напитков с содержанием ортофосфорной кислоты и развитии кариеса. В этом случае кислота растворяет зубную эмаль, а сахар, который так или иначе содержится в напитке, служит питательной средой для развития бактерий. Раствор кислоты в концентрированном виде приводит к ожогам в случае попадания на кожу и слизистые оболочки. Если регулярно потреблять пищевой антиоксидант из продуктов питания, то это также несет угрозу для здоровья. Вследствие переизбытка в организме Е338 могут возникнуть рвота, тошнота, нарушения в функционировании желудочно-кишечного тракта, потеря аппетита, понос, потеря веса. vesvnorme.net Химия кислоты с фосфоромHPO3 Метафосфорная кислота — одноосновная кислота, простейшая формула которой HPO3; действительный же состав её молекул выражается формулой (HPO3)n, где n = 3,4,5 и т. д. В чистом виде представляет собой стекловидную массу, легко растворимую в воде.
Физико-химические свойства Метафосфорная кислота представляет собой белое стеклообразное вещество, хорошо растворимое в воде и, присоединяя её, постепенно переходит в ортофосфорную кислоту:
Очень ядовитое вещество. h4PO4 Ортофо́сфорная кислота́ (фо́сфорная кислота́) — неорганическая кислота средней силы, с химической формулой h4PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы. При температуре выше 213 °C она превращается в пирофосфорную кислоту h5P2O7. Очень хорошо растворима в воде. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 % водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других растворителях. Фосфорную кислоту получают из фосфата:
Можно получить гидролизомпентахлорида фосфора:
Или взаимодействием с водойоксида фосфора(V), полученного сжиганиемфосфоравкислороде:
С водойреакция идет очень бурно, поэтомуоксид фосфора(V)обрабатывают нагретым до 200 °C концентрированным раствором ортофосфорнойкислоты. Расплавленная ортофосфорная кислотаи её концентрированныерастворыобладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей. h4PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]ClO4. Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:
Качественной реакцией на ион РО43− является образование ярко-жёлтого осадка молибденофосфата аммония:
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли. (дигидрофосфат натрия) (гидрофосфат натрия) (фосфат натрия) Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную. Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
Фосфатыпри прокаливании не разлагаются, исключение составляет фосфат аммония (Nh5)3PO4. Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты. Применение: Используется при пайке в качестве флюса (по окисленной меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшуюкоррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество. В составе гидрожидкостей НГЖ-5У и ее иностранных аналогов. Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках. В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни. Ортофосфорная кислота применяется для протравливания (снятия смазанного слоя) эмали и дентина перед пломбированием зубов. При применении адгезивных материалов 2 и 3 поколения требуется протравливание эмали зуба кислотой, с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение данные этапы несут в себе опасность возникновения различных ошибок и осложнений. При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесенный адгезив не полностью (по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя. Кроме того, не всегда удается полностью удалить ортофосфорную кислоту после её нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность бондинга, а также приводят к образованию так называемой «кислотной мины». С появлением адгезивных материалов 4 и 5 поколения стали использовать технику тотального протравливания (дентин — эмаль). В адгезивных системах 6 и 7 поколения отдельный этап протравливания кислотой отсутвует. Так адгезивы являются самопротравливающимися. Хотя некоторые производители все же рекомендуют для усиления адгезии кратковременно протравливать эмаль и при использовании самопротравливащих адгезивов. h5P2O7 Дифосфорная кислота — неорганическое соединение, четырёхосновная кислородсодержащая кислота с формулой h5P2O7, бесцветные кристаллы, растворимые в воде, образует кристаллогидраты. Получение: Растворение оксида фосфорав воде:
Нагревание ортофосфорной кислоты:
Реакция ортофосфорной кислоты с оксидом фосфора:
Физические свойства: Дифосфорная кислота — белое аморфное или кристаллическое вещество, очень гигроскопично. Существует в двух кристаллических модификациях с температурами плавления 54,3 и 71,5°С, смесь плавится при 61°С. Хорошо растворяется в воде, этаноле, эфире. Является четырёхосновной кислотой с константами диссоциации p K1 = 1, p K2 = 2, p K3 = 6,6, p K4 = 9,6. Образует кристаллогидраты вида h5P2O7•n h3O, где n = 1, 5 и 6 Химические свойства: При нагревании в вакууме разлагается:
При кипячении водных растворов переходит в ортофосфорную кислоту:
Реагирует с щелочами с образованием нормальных или кислых солей:
Вступает в обменные реакции:
studfiles.net Ортофосфорная кислота 75-85%Ортофосфорная кислота, является неорганической кислотой средней силы. Химическая формула вещества, выглядит следующим образом - h4PO4. В стандартных условиях, выглядит как гигроскопичные кристаллы не имеющие цвета. При повышении температуры, выше двухсот тринадцати градусов, она превращается в пирофосфорную кислоту, химическая формула которой - h5P2O7. Ортофосфорная кислота, прекрасным образом, растворяется в воде. Помимо воды, она способна растворяться в этаноле и других растворителях. Потребитель имеет дело не с чистой кислотой, а с восьмидесяти пяти процентным водным раствором, который не имеет цвета и запаха, а по своей структуре напоминает сироп. Ортофосфорная кислота - основные свойстваСамым главным свойством данной кислоты, является то, что она воздействует на кислотно-щелочной баланс организма, а это в свою очередь приводит к увеличению кислотности. Всем давно известно, что повышенная кислотность способствует увеличению риска возникновения многих заболеваний, таких как ранний остеопороз и кариес. В высоких концентрациях, ортофосфорная кислота способна вызвать такие поражения кожного покрова, как ожоги. Пары, которые образовываются в следствии ее испарения, могут вызвать кровотечение из носа, атрофические процессы в слизистой оболочке носа, а также привести к разрушению зубов и изменению формулы крови. Ортофосфорная кислота - получение и взаимодействиеДанное вещество, можно получить тремя способами:
Взаимодействует с ограниченным количеством веществ, а именно с:
Область применения Немного выше, было написано о том, что ортофосфорная кислота, повышает кислотность в организме человека. Так вот, в пищевой промышленности она встречается довольно часто. Но давайте обо всем и по порядку. Итак, эта кислота применяется в:
Помимо основных направлений, ее используют в пайке по окисленной меди, черному металлу и нержавеющей стали, в качестве флюса. Несколько реже, ее используют для исследований в молекулярной биологии. Иногда она задействована в очищении от ржавчины различных предметов из металла. Плюсом такой очистки, есть то, что после такой процедуры на поверхности металла образуется защитная пленка, которая в дальнейшем препятствует развитию губительной коррозии. Ортофосфорную кислоту, можно обнаружить в составе фреонов, в качестве связующего вещества, которым заправлены промышленные морозильные установки. Авиационная промышленность. Здесь ортофосфорная кислота входит в состав гидрожидкостей НГЖ-5У, а также в состав ее зарубежных аналогов. Сельское хозяйство. На первый взгляд, это очень необычное вещество для такой отрасли, но если посмотреть под другим углом, то все становится на круги своя. Используют ее в звероводстве. Основное направление - выращивание норок. Применяют не сам раствор в чистом виде, а выпойку из него для профилактики повышенной кислотности в желудках животных, а также для профилактики мочекаменной болезни. Стоматология. Ортофосфорная кислота применяется перед началом пломбирования зубов для протравливания дентина и эмали. Это не самое лучшее средство для снятия смазанного слоя, поскольку достаточно сложно проконтролировать глубину и сложность деминерализации дентина и эмали. Стоматологи на практике, сталкиваются с тем, что эту кислоту порой достаточно сложно полностью удалить после нанесения. Пищевая промышленность. Вот он, настоящий рай для ортофосфорной кислоты. Здесь она себя может проявить со всех сторон. В пищевой промышленности, ее даже официально зарегистрировали в качестве пищевой добавки Е338. Применяют эту добавку в основном в газированных напитках, таких как всем известная Кока-Кола, в качестве регулятора кислотности. Добавляют ее для того чтобы придать напиткам или пище кислинку. В больших количествах, может появиться привкус остроты. Ортофосфорная кислота, нашла свое применение при изготовлении сахара, хлебопекарных порошков, плавленных сырков, колбас и ароматизированных напитков, благодаря доступной стоимости и легкому получению. Упаковка, транспортировка и особенности храненияОртофосфорная кислота, пакуется в полиэтиленовые или стеклянные бутыли, гуммированные стальные цистерны, бочки, канистры, IBC контейнеры. Тара должна быть чистой и сухой. Обязательным условием, является целостность упаковки, так как речь идет о кислоте. Транспортировать ортофосфорную кислоту, можно в гуммированных или стальных железнодорожных цистернах, а также в специальных автоцистернах, которые предназначены для транспортировки опасных веществ. Хранят вещество в складских отапливаемых помещениях. Ортофосфорная кислота, должна храниться в упаковке от производителя. Если были соблюдены все условия транспортировки и хранения, то гарантийный срок годности, составляет три года с момента ее производства. Закристаллизованная ортофосфорная кислота, прекрасно возвращается в жидкое состояние если ее постепенно нагреть до температуры в шестьдесят градусов. Безопасность превыше всего!Соблюдение мер предосторожности еще никому и никогда не повредило, а вот игнорирование потенциальной опасности, может привести к плачевным последствиям. Когда речь идет о кислоте, то всегда следует помнить о том, что все кислоты могут вызвать химические ожоги кожного покрова. Знаете ли вы, чем опасны химические ожоги? Если на кожу попала хоть капля кислоты и вы не придали этому значения, то готовьтесь к тому, что уже через некоторое время на месте попадания, образуется как минимум, красное пятно, которое будет вызывать болезненные ощущения. При поражении кислотами больших объемов тела, могут возникнуть точно такие же ожоги как и термические. Разница между термическим ожогом и химическим в том, что термический не поражает соседние здоровые поверхности, в то время, как химический ожог склонен к углублению и распространению. Ортофосфорная кислота, это такая же кислота как и другие, поэтому работать с ней необходимо очень аккуратно. Народным умельцам, которые хотят с ее помощью избавиться от коварной ржавчины на любимом автомобиле или на другой дорогой сердцу железке, можно посоветовать не работать с ней в закрытых помещениях, не пренебрегать респиратором, надевать защитную одежду и защищать руки специальными резиновыми рукавицами. Для того чтобы избежать попадания ортофосфорной кислоты в глаза, необходимо использовать специальные защитные очки. Что делать, если ортофосфорная кислота попала на кожу? Первое, что от вас потребуется - успокоится и не паниковать. Если есть телефон, то вызвать скорую помощь. Дальнейшие действия следующие:
alhim.com.ua Ортофосфорная кислота для пайки алюминия, нержавейки, радиаторовСуществует масса разновидностей флюса, которые помогают бороться с основными проблемами во время пайки металлов. Ортофосфорная кислота для пайки является достаточно распространенным видом флюса. Она также применяется для очищения металлических деталей от ржавчины последующей защит, так как после ее воздействия на металле появляется защитная пленка, которая помогает защитить от образования коррозии и прочих негативных явлений. Это неорганическое вещество, формула которого выглядит как Н3РО4. При стандартных условиях она имеет вид бесцветных гигроскопичных кристаллов. Если вещество нагреть выше 213 градусов Цельсия, то оно превратится в пирофосфорную кислоту, формула которой является Н4Р2О7.  Ортофосфорная кислота для пайки алюминия, нержавейки Когда ортофосфорная кислота применяется для пайки, то ее чаще всего используют для соединения низколегированных и углеродистых сталей, меди, а также сплавов данных материалов. Механизм действия вещества относительно прост, так как флюс растворяет оксидную пленку, которая образуется на металле основного материала и на припое. Она разрыхляется и всплывает на поверхности флюса. После этого в зоне расчистки создается защитная пленка, которая не дает поверхности вновь окисляться. Все остатки вещества можно смыть при помощи воды. Все это подробно показывает, для чего нужна кислота при пайке. Этот флюс может послужить, когда идет пайка нержавейки, а также никеля и его сплавов. Он имеет практически универсальное применение, так как может работать с черными металлами. Канифоль для пайки не обладает столь широким спектром действия, а также кислотой намного легче паять. Но в то же время кислотой не стоит паять контакты, так как она будет попросту съедать материал. Ортофосфорная кислота может растворяться этаноле и прочих растворителях. Помимо этого вещество используется еще в ряде промышленных направлений. Производство осуществляется согласно ГОСТ 10678-76. Разновидности ортофосфорной кислоты | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Параметры | Значение параметров |
| Как выглядит вещество | Светло-желтая или прозрачная жидкость |
| Плотность флюса, г/см в квадрате | 1,69 |
| Растворяется ли в воде | да |
| Сила давления паров при температуре 20 градусов Цельсия, Па | 4 |
| Соотношение ортофосфорной кислоты в общей массе флюса, % | 73 |
| Доля сульфатов в общей массе, % | 0,35 |
| Доля железа в общей массе, % | 0,04 |
| Доля мышьяка в общей массе, % | 0,0005 |
| Доля тяжелых металлов сероводородной группы в общей массе, % | 0,001 |
| Доля фтористых соединений в общей массе, % | 0,0005 |
| Доля трибутилфосфата в общей массе,% | 0,0005 |
| Доля взвешенных частиц в общей массе, % | 0,05 |
Особенности выбора 
Если вам предстоит пайка низкоуглеродистых сталей, то использование ортофосфорной кислоты будет одним из лучших решений. Данный флюс используется в тех случаях, когда требуется проводить работу с трудно спаиваемыми материалами. Зачастую сама кислота составляет около 75% от всей массы флюса. Наличие добавок является важным элементом, так как они помогают справиться с основными сложностями во время спаивания. Благодаря им, ортофосфорная кислота пайки нержавейки помогает провести эту процедуру с высоким уровнем качества.
Как правило, производители стараются придерживаться одного и того же состава, который соответствует принятому ГОСТу, так что большого разнообразия разновидностей не наблюдается. Тем не менее, когда дело доходит до осмотра уже готового материала, то здесь можно сделать некоторые выводы по поводу качества. В первую очередь следует обращать внимание на наличие осадка, так как он является негативным явлением и чем его больше, тем хуже качество кислоты для пайки. Особенно хорошо это заметно в больших емкостях.
При выборе также стоит обращать внимание на цвет, так как чем более темный оттенок имеет вещество, тем больше в нем примесей.

Ортофосфорная кислота с разными химическими примесями
Это не всегда является негативным моментом, так как некоторые добавки. Которые улучшают свойства спаивания, могут создавать красящий эффект. Но слишком темные жидкости лучше не выбирать, так как стандартным оттенком для вещества является светло-желтый. Тара для хранения и перевозки также имеет большое значение. Чаще всего она поставляется в небольших стеклянных или пластиковых бутылках, емкостью около 10 мл, что удобно для использования. «Важно! Это один из тех случаев, когда срок хранения имеет высокое значение, так что его следует всегда проверять при покупке, тем более что в большинстве случаев кислоту нельзя хранить более 6 месяцев.»
Особенности применения и пайки ортофосфорной кислотой 
Ортофосфорная кислота для пайки алюминия и прочих металлов относится к вредным для здоровья человека веществам. Она пожаро- и взрывобезопасна, но хранить ее нужно в плотно закрытой емкости.
«Важно!
Во время пайки следует обеспечить хорошее проветривание, особенно, если речь идет о домашних условиях.»
Необходимо использовать средства индивидуальной защиты, а если вещество все же попало на кожу, то нужно промыть этот участок большим количеством проточной воды использованием мыла.
Сам процесс пайки практически не отличается от использования других видов флюса. Перед пайкой поверхность металла нужно зачистить, а потом обработать флюсом. Благодаря активному воздействию кислоты, даже если останется ржавчина или какой-либо налет после этого, поверхность станет полностью пригодной для нанесения припоя. Действие ортофосфорной кислоты происходит достаточно быстро, поэтому, после нанесения сразу же можно наносить расплавленный припой, а после его остывания можно смыть остатки флюса обыкновенной водой.
Производители
- МегаХим;
- НижегородХимПродукт;
- Иркутский Химический Завод;
- «Химия» Ростов-на-Дону.
svarkaipayka.ru
Ортофосфорная кислота: применение в быту
Всем привет!
Продолжаю рассказывать о кислотах. И сегодня на очереди – ортофосфорная кислота. Почему я решила рассказать именно о ней? Во-первых, про нее многие слышали (в основном в страшилках о «Кока-Коле»), а во-вторых, слышать-то слышали, но мало кто задумывался о том, что это такое и с чем ее едят – причем, в прямом и переносном смысле.
Да, мы действительно едим это вещество. Фосфорная (или ее правильное химическое название – ортофосфорная) кислота может использоваться как пищевая добавка и даже имеет свое обозначение в перечне таких добавок – Е338.
Итак, давайте обо все по порядку. Ортофосфорная кислота: применение, свойства и некоторые страшные мифы о ней.
Что это такое
Если коротко, фосфорная кислота – это бесцветные кристаллы, которые очень хорошо впитывают в себя воду (это называется гигроскопичностью) и плавятся при температуре всего лишь в 42 градуса.
Она очень хорошо растворяется в воде, образуя привычный раствор кислоты, который и используется в разных целях. Кстати, с точки зрения химии эта кислота является слабой, ее силу никак не сравнить с такими «монстрами» как серная или азотная кислоты. Что, впрочем, не означает, что при работе с ней можно пренебрегать правилами техники безопасности.
Где применяется
Так же, как и лимонная кислота, фосфорная производится в больших количествах – около 50 миллионов тонн ежегодно во всем мире. Для чего же так много, спросите вы?
90 процентов фосфорной кислоты используется для производства удобрений.
Вы все еще продолжаете думать, что удобрения – это яд, от которого нужно бежать как от чумы? Зря. Честно скажу, даже я, как химик, настороженно отношусь к использованию удобрений, но дело здесь не в них, а в людях. Убивает не оружие, а руки, которые это оружие держат и голова, которая отдает команду рукам. Так же и с удобрениями – все должно быть в меру и строго по показанием, как с лекарством.

Нужно очень тщательно соотносить пользу и вред, продумывать возможные последствия, рассчитывать необходимые дозы, короче – грамотно подходить к использованию любых химических веществ, в том числе и удобрений.
В связи с этим мне вспоминается где-то прочитанная то ли шутка, то ли действительно случившаяся история. Я уже забыла, где мне это попалось. Если кто-то из вас знает первоисточник, поделитесь информацией.
Социологи провели опрос, вредны ли минеральные удобрения. Девяносто процентов опрошенных ответили, да, несомненно. У остальных была «пятерка» по химии…
Но возвращаемся к удобрениям. Какие они бывают? Самые распространенные фосфорные удобрения – это:
- простой суперфосфат,
- двойной суперфосфат.
Отличие в том, что в первом содержится двадцать процентов полезного компонента, во втором – сорок.
Их получают из природных минералов фосфорита и апатита. Они тоже содержат фосфор в виде фосфата кальция, но в нерастворимой форме, то есть растения не смогут его усвоить. Поэтому эти минералы перерабатывают и получают легко растворимые вещества, из которых фосфор хорошо усваивается растениями.
Думаю, чуть позже я обязательно напишу и про микроэлементы, необходимые растениям для нормального роста и развития, а также про удобрения.
А сейчас переходим к другим областям применения фосфорной кислоты. Напоминаю, на них остается всего 10 процентов от ее общего количества. Это:
- использование в качестве катализатора в некоторых органических синтезах,
- создание антикоррозионных покрытий на металлах,
- осветление сахарозы,
- очистка от ржавчины металлических изделий,
- при паянии в качестве флюса,
- получение разных химических реактивов,
- некоторые соли этой кислоты используют при производстве эмалей,
- соли также используются в фармацевтической промышленности.
Ну и, конечно же, это наша «любимая» пищевая добавка Е338. Используется она как регулятор кислотности, причем, чаще всего, в газированных напитках.

Кроме них она также часто добавляется в:
- сыры (чаще всего плавленые).
- колбасы,
- сдобу,
- мармелад,
- детское питание,
- молоко,
- и многие другие продукты.
Например, в вареной колбасе содержится 0,4 г этого вещества на 100 г колбасы. В «Коле» — всего 0,06 г. Как видите, концентрации очень низкие. Эта кислота изучена уже давно и очень тщательно, поэтому все нормы ее в продуктах тщательно высчитаны и много раз перепроверены. Так что, не нужно бояться, что эти добавки принесут какой-то вред организму.
А вот если их не будет, то продукт послужит прекрасным домом для размножения самых разных микроорганизмов, и вот это уже точно не принесет вам никакой пользы.
Правда, нужно учесть, что сладкие газированные напитки – сами по себе не полезны. Здесь тандем «ортофосфорная кислота + сахар» однозначно вреден для человека. Точнее, для зубов. Кислота разрушает эмаль, а сахар охотно поедают бактерии, живущие на зубах. Я об этом уже упоминала в статье про фтор в зубных пастах. Увлекаетесь такими напитками? Тогда либо тщательнее ухаживайте за зубами, либо будьте готовы к быстрому развитию кариеса.
Это было небольшое отступление от темы. Теперь предлагаю подробнее остановиться на страшилках про «Кока-колу».
Содержание в «Кока-Коле»
Да, в ней действительно есть ортофосфорная кислота. Именно поэтому этим напитком можно чистить от ржавчины различные железные предметы. Некоторые творческие личности даже унитазы ею чистят от налета.
А как быть с желудком? Да никак. Все крики о том, что это вещество будет разъедать желудок – всего лишь ничем не обоснованные эмоции. Предлагаю просто взять и посчитать.
Кислотность желудочного сока (еще говорят рН) – примерно 1-2. А кислотность «Кока-Колы» — 3. Такой же кислотностью обладают многие свежевыжатые соки, например, грейпфрут, яблочный сок, некоторые вина.
Внимание, сейчас будет стррррашная химия и математика! рН – это отрицательный десятичный логарифм концентрации ионов водорода. Исходя из этого, концентрация кислоты желудочного сока в 10-100 раз выше, чем концентрация несчастной «Колы». Так что, ни о какой жуткой кислоте в напитке говорит не нужно. Ее там очень мало. И вред она может представлять только для тех, у кого проблемы с желудком. Да и то, если ее пить каждый день хотя бы по паре литров.
Что же касается вреда газированных напитков, то я с этим абсолютно согласна. Вопрос только в том, какие именно содержащиеся в них вещества представляют опасность. На мой взгляд, вопрос достаточно сложный и спорный.
У кого какие идеи – пишите в комментариях.
И последнее, не по теме ![]() Хочу поделиться своей радостью. Нам наконец-то вернули гитару, долгое время находившуюся в ремонте. И я наконец-то начала учиться играть на гитаре, о чем мечтала еще со школы. Занимаюсь пока по курсу Романа Ерина, так как слышала о нем много хороших отзывов. Мне тоже нравится. Но, может, кто-то еще что-то посоветует? Жду ваши ответы в комментариях.
Хочу поделиться своей радостью. Нам наконец-то вернули гитару, долгое время находившуюся в ремонте. И я наконец-то начала учиться играть на гитаре, о чем мечтала еще со школы. Занимаюсь пока по курсу Романа Ерина, так как слышала о нем много хороших отзывов. Мне тоже нравится. Но, может, кто-то еще что-то посоветует? Жду ваши ответы в комментариях.
И совсем последнее не по теме. Решила принять участие в кулинарном конкурсе на "Блоге народных знаний" Анатолия Кравченко. Просто у меня скопилось много очень простых рецептов, которыми хочется поделиться. Свой кулинарный сайт я не потяну, да и не интересно мне постоянно им заниматься, а вот в конкурсе с удовольствием приму участие.
Так что, у кого есть интересные рецепты — присоединяйтесь!
Вот теперь точно все на сегодня!
Всем удачи и хорошего настроения!
Наталья Брянцева
KidsChemistry теперь есть и в социальных сетях. Присоединяйтесь прямо сейчас! Google+, В контакте, Одноклассники , Facebook, Twitter
kidschemistry.ru
Ортофосфорная кислота | Info-Farm.RU
Ортофосфорная кислота, фосфорной кислоты — неорганическое соединение, кислота состава Н 3 PO4, которая образует ряд солей ортофосфатов (фосфатов). При комнатной температуре является белой кристаллическим веществом, а при нагревании до 42,35 ° C превращается в бесцветную вязкую жидкость.
Широко применяется для получения минеральных удобрений, для создания защитных покрытий, в производстве косметики и стекла.
Физические свойства
При нормальных условиях ортофосфорная кислота представляет собой бесцветную и расплывчатую на воздухе кристаллическое соединение с температурой плавления 42 ° С (65% раствор кислоты замерзает только при -85 ° С). В твердом состоянии и в растворе молекулы ортофосфорной кислоты ассоциированные за счет водородных связей, и поэтому концентрированные растворы имеют высокую вязкость. Фосфатный кислота хорошо растворяется в воде (до 80% по массе). Ее водные растворы — хорошие электролиты (высшая электропроводность наблюдается тогда, когда концентрация кислоты составляет 48%).
В отличие от многих соединений фосфора, фосфорной кислоты не ядовита.
Плотность — 1,87 г / см³. Температура плавления 42,35 ° С. В воде растворяется очень хорошо и в водном растворе является кислотой средней силы. Образует гемигидрат состава H 3 PO4 · 0,5H 2 O.
Получение
Для получения ортофосфорной кислоты применяются в основном два метода: метод влажного травления и термальный метод. Первый метод является наиболее востребованным для синтеза больших количеств кислоты, он заключается в обработке природных фосфатов минеральными кислотами, в основном серной (азотная и соляная кислоты используются значительно реже). Получаемая таким методом кислота называется влажной фосфатной кислотой.
Производство кислоты с термальным методом происходит путем окисления фосфора, получаемого из фосфатов, до оксида P 4 O 10 и последующей гидратацией.
Метод влажного травления
Несмотря на то, что принцип пищеварения фосфатов был разработан еще в 1880-х годах, его активное применение началось только после окончания Второй мировой войны — в ответ на стремительный рост спроса на минеральные удобрения.
В качестве основного сырья для пищеварения применяется апатит, который является весьма распространенным минералом:
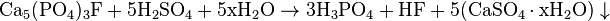 (x = 0,1 … 2,2)
(x = 0,1 … 2,2) Для лучшего отделения малорастворимого гидрата сульфата кальция, реакцию обычно проводят в двух температурных режимах: при 70-80 ° C осадок выделяется преимущественно в форме дигидрата CaSO 4 · 2H 2 O, а при 80-90 ° C — в форме гемигидрата CaSO 4 · 0 , 5H 2 O. Вне этих температурных диапазонов осаждения происходит неэффективно.
Дигидратний процесс
Для проведения осаждения за дигидратним методом выходной фосфат размалывают до размера частиц в 150 мкм (не менее 75% гранулометрического состава). Концентрация конечного раствора кислоту варьируется в пределах 28-31% P 2 O 5.
Дигидратний процесс имеет большее применение, поскольку проводится по меньшей температуры, помогает снизить износ оборудования и коррозионные процессы. Также процесс позволяет использование в пищеварении большего количества фосфатных пород. К недостаткам этого способа относят сравнительно невысокую концентрацию раствора кислоты и относительно большие потери оксида (до 4-6%).
Гемигидратний процесс
Гемигидратний процесс значительно дороже в производстве, но позволяет получать растворы с концентрацией 40-50% P 2 O 5. В основном гемигидратний процесс проводится в комплексе с дигидратним. Один из первых Двухстадийная процессов был разработан в Японии, где остро стоял вопрос получения сверхчистого сульфата кальция для производства строительных материалов (в Японии отсутствуют природные залежи гипса).
В зависимости от порядка проведения осаждения за дигидратним (ДГ) и гемигидратним (ГГ) методами, различают:
концентрация конечного раствора — 40-48% P 2 O 5 одностадийная фильтрация осадок — CaSO 4 · 0,5H 2 O (с примесями)- ГГ / ДГ процесс без промежуточной фильтрации:
- ГГ / ДГ процесс с промежуточной фильтрацией:
- ДГ / ГГ процесс:
Термальный метод
Производство ортофосфорной кислоты с термальным методом проводится путем сжигания белого (желтого) фосфора в кислороде воздуха и последующим растворением в воде:
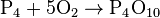
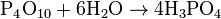
Процесс IG
По методу компании «IG» окисления проводится в цилиндрических реакторах, в которых сверху впрыскивается смесь кислорода и атомизованого фосфора, а внизу находится вода для поглощения образованного оксида. Поскольку сжигание фосфора происходит с большим тепловым эффектом (достигается температура свыше 2000 ° C), по внутренней стороне стенок реактора подается охлажденная фосфатный кислота, которая предотвращает чрезмерное влияния температуры на металл. Все детали реактора производятся из низкоуглеродистой стали или резины — эти материалы не подвергаются воздействию кислоты при температурах до 100 ° C.
Концентрация конечной кислоты регулируется подачей воды для смешивания, а также охлаждением реакторов. Конечный продукт может иметь незначительную примесь фосфитнои кислоты (около 0,1%), которая образуется из полностью окисленного оксида фосфора (III).
Процесс TVA
Компанией «Tennessee Valley Authority» (TVA) была предложена модификация термального метода: сожжение фосфора происходит в отдельной камере, дает больше времени на окисление. Твердые продукты окисления частично оседают на стенках и поглощают часть тепла, выделяемого в результате реакции, а также экранируют металл реактора от чрезмерного воздействия температуры.
Накопленный оксид фосфора растворяется в ортофосфорной кислоте с образованием полифосфатных кислот H n + 2P n O 3n + 1, которые имеют значительно большее содержание P 2 O 5. Так, по методу TVA получают раствор кислот с концентрацией 85% P 2 O 5, что соответствует концентрации ортофосфорной кислоты в 117%. При изготовлении камер для сжигания из графита, накопленный оксид фосфора (V) образует растворы кислот с концентрацией до 92% P 2 O 5.
Концентрирования
Концентрирования ортофосфорной кислоты до значений 40-55% P 2 O 5 видбуваетьcя путем испарения воды в вакууме при температурах около 120 ° C. Для достижения содержания оксида фосфора в 70% (суперфосфатная кислота), нагрев повышают до 200 ° C.
Химические свойства
При нагревании до 150 ° C происходит межмолекулярное дегидратация с образованием пирофосфатных кислоты:
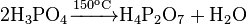
Дальнейшим нагреванием образуется трифосфатных кислота H 5 P 3O 10.
Увеличение температуры при нагревании в вакууме прозводить к образованию метафосфатнои кислоты:
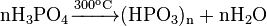
В водном растворе ортофосфорная кислота распадается ступенчато:
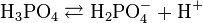 (K 1 = 7,1 · 10 -3)
(K 1 = 7,1 · 10 -3) 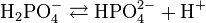 (K 2 = 6,3 · 10 -8)
(K 2 = 6,3 · 10 -8) 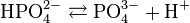 (K 3 = 4,4 · 10 -13)
(K 3 = 4,4 · 10 -13) Проявляя кислотные свойства, ортофосфорная кислота реагирует с гидроксидами (ступенчато):
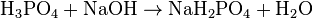
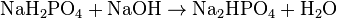
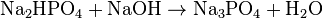
Взаимодействует с активными металлами с выделением водорода:
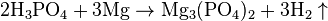
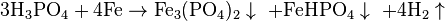
При взаимодействии с оксидом фосфора (V), соединение концентрируется с образованием пирофосфатных кислоты:
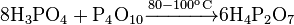
Концентрированная ортофосфорная кислота в присутствии концентрированной HNO 3 способна образовывать с металлами гетерополисполукы, например, фосфоромолибдатну кислоту:
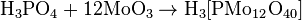
Применение
Промышленная ортофосфорная кислота — это важнейший полупродукт для производства фосфорных и комплексных удобрений (кормовых фосфатов для животноводства) и технических фосфатов, широко используется также для фосфатирования металлов, производства зубных паст, как катализатор в органическом синтезе. А также для очистки металлических поверхностей и создания антикоррозионных покрытий.
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки Е338. Применяется как регулятор кислотности в газированных напитках (вроде «Кока-кола» и «Пепси»). Есть сведения, что она приводит к вымыванию кальция из организма человека уже через час после употребления.
info-farm.ru
Ортофосфорная кислота — WiKi
Ортофо́сфорная кислота́ (фо́сфорная кислота́) — неорганическая кислота средней силы, с химической формулой h4PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы.
| Ортофосфорная кислота | |
| Ортофосфорная кислота | |
| h4PO4 | |
| твердое | |
| 98,0 г/моль | |
| 1,685 (жидк) | |
| 2,4-9,4 сПуаз | |
| +42,35 °C | |
| +158 °C | |
| 0,03±0,01 мм.рт.ст.[1] | |
| 2,12; 7,21; 12,67 | |
| 548 г/100 мл | |
| 7664-38-2 | |
| 1004 | |
| 231-633-2 | |
| E338 | |
| TB6300000 | |
| 26078 | |
| 1805 | |
| 979 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
При температуре выше +213 °C она превращается в пирофосфорную кислоту h5P2O7. Очень хорошо растворима в воде. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85%-й водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других растворителях.
Получение
Фосфорную кислоту получают из фосфатов, например воздействуя на фосфат кальция (минерал апатит) серной кислотой:
Ca3(PO4)2+3h3SO4→3CaSO4+2h4PO4{\displaystyle {\mathsf {Ca_{3}(PO_{4})_{2}+3H_{2}SO_{4}\rightarrow 3CaSO_{4}+2H_{3}PO_{4}}}}Можно получить гидролизом пентахлорида фосфора:
PCl5+4h3O→h4PO4+5HCl{\displaystyle {\mathsf {PCl_{5}+4H_{2}O\rightarrow H_{3}PO_{4}+5HCl}}}Или взаимодействием с водой оксида фосфора(V), полученного сжиганием фосфора в кислороде:
P2O5+3h3O→2h4PO4{\displaystyle {\mathsf {P_{2}O_{5}+3H_{2}O\rightarrow 2H_{3}PO_{4}}}}С водой реакция идёт очень бурно, поэтому оксид фосфора(V) обрабатывают нагретым до 200 °C концентрированным раствором ортофосфорной кислоты.
Расплавленная ортофосфорная кислота и её концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
Свойства
h4PO4 — трёхосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]ClO4.
В водных растворах подвергается электролитической диссоциации в три стадии с образованием катиона гидроксония. Степень диссоциации и вид зависят от pH раствора:
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра, при этом образуется жёлтый осадок:
h4PO4+3AgNO3→Ag3PO4+3HNO3{\displaystyle {\mathsf {H_{3}PO_{4}+3AgNO_{3}\rightarrow Ag_{3}PO_{4}+3HNO_{3}}}}Качественной реакцией на ион h3РО4− является образование ярко-жёлтого осадка молибденофосфата аммония:
h4PO4+12[Nh5]2MoO4+21HNO3→[Nh5]3PMo12O40⋅6h3O↓+21Nh5NO3+6h3O{\displaystyle {\mathsf {H_{3}PO_{4}+12[NH_{4}]_{2}MoO_{4}+21HNO_{3}\rightarrow [NH_{4}]_{3}PMo_{12}O_{40}\cdot 6H_{2}O\downarrow +21NH_{4}NO_{3}+6H_{2}O}}} Степень диссоциации ортофосфорной кислоты в зависимости от кислотности раствора.Фосфаты
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
h4PO4+NaOH→Nah3PO4+h3O{\displaystyle {\mathsf {H_{3}PO_{4}+NaOH\rightarrow NaH_{2}PO_{4}+H_{2}O}}} (дигидрофосфат натрия) h4PO4+2NaOH→Na2HPO4+2h3O{\displaystyle {\mathsf {H_{3}PO_{4}+2NaOH\rightarrow Na_{2}HPO_{4}+2H_{2}O}}} (гидрофосфат натрия) h4PO4+3NaOH→Na3PO4+3h3O{\displaystyle {\mathsf {H_{3}PO_{4}+3NaOH\rightarrow Na_{3}PO_{4}+3H_{2}O}}} (фосфат натрия)Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
Nah3PO4→NaPO3+h3O{\displaystyle {\mathsf {NaH_{2}PO_{4}\rightarrow NaPO_{3}+H_{2}O}}} 2Na2HPO4→Na4P2O7+h3O{\displaystyle {\mathsf {2Na_{2}HPO_{4}\rightarrow Na_{4}P_{2}O_{7}+H_{2}O}}}Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (Nh5)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Применение
Используется при пайке в качестве флюса (по окисленной меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Авиационная промышленность
В авиационной промышленности ортофосфорная кислота используется в составе гидрожидкости НГЖ-5У и её иностранных аналогов.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках, например в Кока-Коле. По вкусу подслащённые слабые водные растворы ортофосфорной кислоты напоминают крыжовник.
Сельское хозяйство
В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
Стоматология
Ортофосфорная кислота применяется для протравливания (снятия смазанного слоя) эмали и дентина перед пломбированием зубов. При применении адгезивных материалов 2-го и 3-го поколений требуется протравливание эмали зуба кислотой с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение, данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесённый адгезив не полностью (не по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удаётся полностью удалить ортофосфорную кислоту после её нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность связывания, а также приводят к образованию так называемой «кислотной мины».
С появлением адгезивных материалов 4-го и 5-го поколений стали использовать технику тотального протравливания (дентин — эмаль). В адгезивных системах 6-го и 7-го поколений отдельный этап протравливания кислотой отсутствует, так как адгезивы являются самопротравливающимися. Однако некоторые производители всё же рекомендуют для усиления адгезии кратковременно протравливать эмаль даже при использовании самопротравливащих адгезивов.
Примечания
Литература
- Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. М.: Химия1994
- Блум У. Адгезивные системы обзор и сравнение// Дент. Арт.- 2003,№ 2.-С.5-11.
- Давыдова А. В. Характеристика адгезивных систем// Материалы научно-практической конференции «Новые технологии в стоматологии».- Ростов на Дону, 2004.-С.45-46
- Enamel-dentin adhesives, self-etching primers// CRA Newsletter.- Vol.24,№ 11.-2000.-P.1-2.
ru-wiki.org










