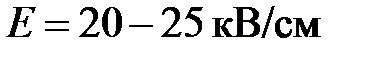Оксид меди (I, II, III): свойства, получение, применение. Медь 2Оксид меди 2, химическая формула и свойстваОксиды — широко распространённый в природе тип соединений, который можно наблюдать даже в повседневной жизни, в быту. Примером могут служить песок, вода, ржавчина, известь, углекислый газ, ряд природных красителей. Руда многих ценных металлов по своей природе является оксидом, вследствие чего представляет большой интерес для научных и производственных исследований. Соединение химических элементов с кислородом называют оксидами. Как правило, образуются они при накаливании каких-либо веществ на воздухе. Различают кислотные и основные оксиды. Металлы образуют основные оксиды, в то время как неметаллы — кислотные. За исключением оксидов хрома и марганца, которые также являются кислотными. В данной статье рассматривается представитель основных оксидов — CuO (II). CuO (II)Медь, нагреваясь на воздухе при температуре 400–500 °C, постепенно покрывается налётом чёрного цвета, который химики называют оксид двухвалентной меди, или CuO(II). Описанное явление представлено в следующем уравнении: 2 Cu + О 2 → 2 CuO Термин «двухвалентный» указывает на способность атома вступать в реакцию взаимодействия с другими элементами посредством двух химических связей. Интересный факт! Медь, находясь в различных соединениях, может быть с разной валентностью и другим цветом. Например: оксиды меди имеют ярко-красную (Cu2O) и коричнево-чёрную (CuO) окраску. А гидроксиды меди приобретают жёлтый (CuOH) и синий (Cu(OH)2) цвета. Классический пример явления, когда количество переходит в качество. Cu2O ещё иногда называют закись, оксид меди (I), а CuO — окись, оксид меди (II). Существует также оксид меди (III) — Cu2O3. В геологии оксид двухвалентной (или бивалентной) меди принято называть тенорит, другое его название — мелаконит. Название тенорит произошло от фамилии выдающегося итальянского профессора ботаники Michele Tenore, (1780—1861). Мелаконит считается синонимом названия тенорит и переводится на русский язык, как медная чернь либо чёрная медная руда. В том или ином случае речь идёт о кристаллическом минерале коричнево-чёрного цвета, разлагающемся при прокаливании и плавящемся только при избыточном давлении кислорода, в воде нерастворимом, и не реагирующем с ней. Акцентируем основные параметры названного минерала. Химическая формула: CuOМолекула его состоит из атома Cu с молекулярной массой 64 а. е. м. и атома O, молекулярная масса 16 а. е. м., где а. е. м. — атомная единица массы, она же дальтон, 1 а. е. м. = 1,660 540 2(10) × 10−27 кг = 1,660 540 2(10) × 10–24 г. Соответственно молекулярная масса соединения равняется: 64 + 16 = 80 а. е. м. Кристаллическая решётка: моноклинная сингония. Что обозначает такой тип осей симметрии кристалла, когда две оси пересекаются под косым углом и имеют различную длину, а третья ось расположена по отношению к ним под углом 90°. Плотность – 6,51 г/см3. Для сопоставления, плотность чистого золота равна 19,32 г/см³, а плотность поваренной соли составляет 2,16 г /см 3. Плавится при температуре 1447 °C, под давлением кислорода. Разлагается при накаливании до 1100 °C и преобразуется в оксид меди (I): 4CuO = 2Cu2O + O 2. С водой не реагирует и не растворяется в ней. Зато вступает в реакцию с водным раствором аммиака, с образованием гидроксида тетраамминмеди (II): CuO + 4Nh4 + h3O = [Cu (Nh4)4](OH) 2. В кислотной среде образует сульфат и воду: CuO + h3SO4 = CuSO4 + h3O. Реагируя со щёлочью, создаёт купрат: CuO + 2 NaOH → Na2CuO2 + h3O. Реакция CuO NaOHОбразуется:
Восстанавливается до металлической меди —
Токсичен. По степени неблагоприятного воздействия на человеческий организм причисляется к веществам второго класса опасности. Вызывает раздражение слизистых оболочек глаз, кожных покровов, дыхательных путей и желудочно-кишечной системы. При взаимодействии с ним обязательно использование таких средств защиты, как резиновые перчатки, респираторы, защитные очки, спецодежду. Вещество взрывоопасно и легко воспламеняется. Применяется в промышленности, как минеральная составляющая комбикормов, в пиротехнике, при получении катализаторов химических реакций, как красящий пигмент для стекла, эмалей, керамики. Окислительные свойства оксида меди (II) наиболее часто применяются в лабораторных исследованиях, когда необходим элементарный анализ, связанный с изучением органических материалов на предмет наличия в них водорода и углерода. Немаловажно, что CuO (II) достаточно широко распространён в природе, как минерал тенерит, другими словами — это природное соединение руды, из которого можно получить медь. Латинское наименование Cuprum и соответствующий ему символ Cu происходит от названия острова Кипр. Именно оттуда, через Средиземное море вывозили этот ценный металл древние римляне и греки. Медь входит в число семи наиболее распространённых в мире металлов и состоит на службе у человека с древних времён. Однако в первозданном, металлическом состоянии встречается довольно редко. Это мягкий, легко поддающийся обработке металл, отличающийся высокой плотностью, очень качественный проводник тока и тепла. По электрической проводимости уступает только серебру, в то время как является более дешёвым материалом. Широко используется в виде проволоки и тонкого листового проката. Химические соединения меди отличаются повышенной биологической активностью. В животных и растительных организмах они участвуют в процессах синтеза хлорофилла, поэтому считаются очень ценным компонентом в составе минеральных удобрений. Необходима медь и в рационе человека. Недостаток её в организме может привести к различным заболеваниям крови. ВидеоИз видео вы узнаете, что такое оксид меди. . liveposts.ru Медь — химические свойства » HimEge.ruМесто меди в Периодической системе химических элементов Д.И. МенделееваМедь расположена в 11 группе Периодической системы химических элементов Д.И. Менделеева. В четвертом периоде медь является предпоследним d-элементом, её валентные электроны 3d94s2, однако вследствие устойчивости d10-состояния энергетическим более выгодным оказывается переход одного d-электрона на 4s-подуровень, поэтому валентные электроны меди имеют следующую конфигурацию: 3d104s1. В соединениях для меди характерная степень окисления +2, возможно проявление степеней окисления +1 и +3. Физические свойства медиМедь – пластичный, розовато-красный металл с металлическим блеском. Обладает высокой тепло- и электропроводностью, по значению электропроводности уступает только серебру. Температура плавления 1083°С, температура кипения 2567°С, плотность 8,92 г/см3. На воздухе медь покрывается плотной зелено-серой пленкой основного карбоната, которая защищает её от дальнейшего окисления. Химические свойства медиС кислородом в зависимости от температуры взаимодействия медь образует два оксида:2Cu + O2 = 2CuO (черный цвет) При температуре около 150 оС металл покрывается темно-красной пленкой оксида меди (I):4Cu + O2 = 2Cu2O При нагревании с фтором, хлором, бромом образуются галогениды меди (II):Cu + Br2 = CuBr2; с йодом – образуется йодид меди (I):2Cu + I2 = 2CuI. Cu + S = CuS4Cu + SO2= Cu2S + 2CuO4Cu + 2NO2 = 4CuO + N2 Взаимодействие с кислотами В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому она не взаимодействует с растворами разбавленной соляной и серной кислот и щелочей. Растворяется в разбавленной азотной кислоте с образованием нитрата меди (II) и оксида азота (II): 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4h3O. Реагирует с концентрированными растворами серной и азотной кислот с образованием солей меди (II) и продуктов восстановления кислот: Cu + 2h3SO4 = CuSO4 + SO2 + 2h3O; Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O. С концентрированной соляной кислотой медь реагирует с образованием трихлорокупрата (II) водорода: Cu + 3HCl = H[CuCl3] + h3 himege.ru Химические свойства переходных металлов (меди, цинка, хрома, железа).Химические свойства медиМедь (Cu) относится к d-элементам и расположена в IB группе периодической таблицы Д.И.Менделеева. Электронная конфигурация атома меди в основном состоянии записывается виде 1s22s22p63s23p63d104s1 вместо предполагаемой формулы 1s22s22p63s23p63d94s2. Другими словами, в случае атома меди наблюдается так называемый «проскок электрона» с 4s-подуровня на 3d-подуровень. Для меди, кроме нуля, возможны степени окисления +1 и +2. Степень окисления +1 склонна к диспропорционированию и стабильна лишь в нерастворимых соединениях типа CuI, CuCl, Cu2O и т. д., а также в комплексных соединениях, например, [Cu(Nh4)2]Cl и [Cu(Nh4)2]OH. Соединения меди в степени окисления +1 не имеют конкретной окраски. Так, оксид меди (I) в зависимости от размеров кристаллов может быть темно-красный (крупные кристаллы) и желтый (мелкие кристаллы), CuCl и CuI — белыe, а Cu2S — черно-синий. Более химически устойчивой является степень окисления меди, равная +2. Соли, содержащие медь в данной степени окисления, имеют синюю и сине-зеленую окраску. Медь является очень мягким, ковким и пластичным металлом с высокой электро- и теплопроводностью. Окраска металлической меди красно-розовая. Медь находится в ряду активности металлов правее водорода, т.е. относится к малоактивным металлам. Взаимодействие с простыми веществамис кислородомВ обычных условиях медь с кислородом не взаимодействует. Для протекания реакции между ними требуется нагрев. В зависимости от избытка или недостатка кислорода и температурных условий может образовать оксид меди (II) и оксид меди (I): с серойРеакция серы с медью в зависимости от условий проведения может приводить к образованию как сульфида меди (I), так и сульфида меди (II). При нагревании смеси порошкообразных Cu и S до температуры 300-400оС образуется сульфид меди (I): При недостатке серы и проведении реакции при температуре более 400оС образуется сульфид меди (II). Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде: Данная реакция протекает при комнатной температуре. с галогенамиС фтором, хлором и бромом медь реагирует, образуя галогениды с общей формулой CuHal2, где Hal – F, Cl или Br: Cu + Br2 = CuBr2 В случае с йодом — самым слабым окислителем среди галогенов — образуется иодид меди (I): С водородом, азотом, углеродом и кремнием медь не взаимодействует. Взаимодействие со сложными веществамис кислотами-неокислителямиКислотами-неокислителями являются практически все кислоты, кроме концентрированной серной кислоты и азотной кислоты любой концентрации. Поскольку кислоты-неокислители в состоянии окислить только металлы, находящиеся в ряду активности до водорода; это означает, что медь с такими кислотами не реагирует. с кислотами-окислителями— концентрированной серной кислотойС концентрированной серной кислотой медь реагирует как при нагревании, так и при комнатной температуре. При нагревании реакция протекает в соответствии с уравнением: Поскольку медь не является сильным восстановителем, сера восстанавливается в данной реакции только до степени окисления +4 (в SO2). — с разбавленной азотной кислотойРеакция меди с разбавленной HNO3 приводит к образованию нитрата меди (II) и монооксида азота: 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4h3O — с концентрированной азотной кислотойКонцентрированная HNO3 легко реагирует с медью при обычных условиях. Отличие реакции меди с концентрированной азотной кислотой от взаимодействия с разбавленной азотной кислотой заключается в продукте восстановления азота. В случае концентрированной HNO3 азот восстанавливается в меньшей степени: вместо оксида азота (II) образуется оксид азота (IV), что связано с большей конкуренцией между молекулами азотной кислоты в концентрированной кислоте за электроны восстановителя (Cu): Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O с оксидами неметалловМедь реагирует с некоторыми оксидами неметаллов. Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2: В случае диоксида серы, вместо простого вещества (серы) образуется сульфид меди(I). Связано это с тем, что медь с серой, в отличие от азота, реагирует: с оксидами металловПри спекании металлической меди с оксидом меди (II) при температуре 1000-2000 оС может быть получен оксид меди (I): Также металлическая медь может восстановить при прокаливании оксид железа (III) до оксида железа (II): с солями металловМедь вытесняет менее активные металлы (правее нее в ряду активности) из растворов их солей: Cu + 2AgNO3 = Cu(NO3)2 + 2Ag↓ Также имеет место интересная реакция, в которой медь растворяется в соли более активного металла – железа в степени окисления +3. Однако противоречий нет, т.к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2: Fe2(SO4)3 + Cu = CuSO4 + 2FeSO4 Cu + 2FeCl3 = CuCl2 + 2FeCl2 Последняя реакция используется при производстве микросхем на стадии травления медных плат. Коррозия медиМедь со временем подвергается коррозии при контакте с влагой, углекислым газом и кислородом воздуха: 2Cu + h3O + СО2 + О2 = (CuOН)2СO3 В результате протекания данной реакции медные изделия покрываются рыхлым сине-зеленым налетом гидроксокарбоната меди (II). Химические свойства цинкаЦинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d104s2. Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами. Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции: 2Zn + h3O + O2 + CO2 → Zn2(OH)2CO3 Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем: При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором: С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Цинк реагирует с кислотами-неокислителями с выделением водорода: Zn + h3SO4 (20%) → ZnSO4 + h3↑ Zn + 2HCl → ZnCl2 + h3↑ Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди. Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди. При температуре 800-900oC (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород: Zn + h3O = ZnO + h3↑ Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной. Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород. Zn + 2h3SO4 = ZnSO4 + SO2↑ + 2h3O Состав продуктов восстановления азотной кислоты определяется концентрацией раствора: Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2↑ + 2h3O 3Zn + 8HNO3(40%) = 3Zn(NO3)2 + 2NO↑ + 4h3O 4Zn +10HNO3(20%) = 4Zn(NO3)2 + N2O↑ + 5h3O 5Zn + 12HNO3(6%) = 5Zn(NO3)2 + N2↑ + 6h3O 4Zn + 10HNO3(0,5%) = 4Zn(NO3)2 + Nh5NO3 + 3h3O На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции.Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород: Zn + 2NaOH + 2h3O = Na2[Zn(OH)4] + h3↑ Zn + Ba(OH)2 + 2h3O = Ba[Zn(OH)4] + h3↑ С безводными щелочами цинк при сплавлении образует цинкаты и водород: В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака: 4Zn + NaNO3 + 7NaOH + 6h3O → 4Na2[Zn(OH)4] + Nh4↑ Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород: Zn + 4Nh4·h3O → [Zn(Nh4)4](OH)2 + h3↑ + 2h3O Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей: Zn + CuCl2 = Cu + ZnCl2 Zn + FeSO4 = Fe + ZnSO4 Химические свойства хромаХром — элемент VIB группы таблицы Менделеева. Электронная конфигурация атома хрома записывается как 1s 22s 22p 63s 23p63d54s1, т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона» Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет. При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде. Взаимодействие с неметалламис кислородомРаскаленный до температуры более 600 oС порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III): 4Cr + 3O2 =ot=> 2Cr2O3 с галогенамиС хлором и фтором хром реагирует при более низких температурах, чем с кислородом (250 и 300 oC соответственно): 2Cr + 3F2 =ot=> 2CrF3 2Cr + 3Cl2 =ot=> 2CrCl3 С бромом же хром реагирует при температуре красного каления (850-900 oC): 2Cr + 3Br2 =ot=> 2CrBr3 с азотомС азотом металлический хром взаимодействует при температурах более 1000 oС: 2Cr + N2 =ot=> 2CrN с серойС серой хром может образовывать как сульфид хрома (II) так и сульфид хрома (III), что зависит от пропорций серы и хрома: Cr + S =ot=> CrS 2Cr + 3S =ot=> Cr2S3 С водородом хром не реагирует. Взаимодействие со сложными веществамиВзаимодействие с водойХром относится к металлам средней активности (расположен в ряду активности металлов между алюминием и водородом). Это означает, что реакция протекает между раскаленным до красного каления хромом и перегретым водяным паром: 2Cr + 3h3O =ot=> Cr2O3 + 3h3↑ Взаимодействие с кислотамиХром при обычных условиях пассивируется концентрированными серной и азотной кислотами, однако, растворяется в них при кипячении, при этом окисляясь до степени окисления +3: Cr + 6HNO3(конц.) =to=> Cr(NO3)3 + 3NO2↑ + 3h3O 2Cr + 6h3SO4(конц) =to=> Cr2(SO4)3 + 3SO2↑ + 6h3O В случае разбавленной азотной кислоты основным продуктом восстановления азота является простое вещество N2: 10Cr + 36HNO3(разб) = 10Cr(NO3)3 + 3N2↑ + 18h3O Хром расположен в ряду активности левее водорода, а это значит, что он способен выделять h3 из растворов кислот-неокислителей. В ходе таких реакций в отсутствие доступа кислорода воздуха образуются соли хрома (II): Cr + 2HCl = CrCl2 + h3↑ Cr + h3SO4(разб.) = CrSO4 + h3↑ При проведении же реакции на открытом воздухе, двухвалентный хром мгновенно окисляется содержащимся в воздухе кислородом до степени окисления +3. При этом, например, уравнение с соляной кислотой примет вид: 4Cr + 12HCl + 3O2 = 4CrCl3 + 6h3O При сплавлении металлического хрома с сильными окислителями в присутствии щелочей хром окисляется до степени окисления +6, образуя хроматы: Химические свойства железаЖелезо Fe, химический элемент, находящийся в VIIIB группе и имеющий порядковый номер 26 в таблице Менделеева. Распределение электронов в атоме железа следующее 26Fe1s22s22p63s23p63d64s2, то есть железо относится к d-элементам, поскольку заполняемым в его случае является d-подуровень. Для него наиболее характерны две степени окисления +2 и +3. У оксида FeO и гидроксида Fe(OH)2 преобладают основные свойства, у оксида Fe2O3 и гидроксида Fe(OH)3 заметно выражены амфотерные. Так оксид и гидроксид железа (lll) в некоторой степени растворяются при кипячении в концентрированных растворах щелочей, а также реагируют с безводными щелочами при сплавлении. Следует отметить что степень окисления железа +2 весьма неустойчива, и легко переходит в степень окисления +3. Также известны соединения железа в редкой степени окисления +6 – ферраты, соли не существующей «железной кислоты» h3FeO4. Указанные соединения относительно устойчивы лишь в твердом состоянии, либо в сильнощелочных растворах. При недостаточной щелочности среды ферраты довольно быстро окисляют даже воду, выделяя из нее кислород. Взаимодействие с простыми веществамиС кислородомПри сгорании в чистом кислороде железо образует, так называемую, железную окалину, имеющую формулу Fe3O4 и фактически представляющую собой смешанный оксид, состав которого условно можно представить формулой FeO∙Fe2O3. Реакция горения железа имеет вид: 3Fe + 2O2 =to=> Fe3O4 С серойПри нагревании железо реагирует с серой, образуя сульфид двухвалентого железа: Fe + S =to=> FeS Либо же при избытке серы дисульфид железа: Fe + 2S =to=> FeS2 С галогенамиВсеми галогенами кроме йода металлическое железо окисляется до степени окисления +3, образуя галогениды железа (lll): 2Fe + 3F2 =to=> 2FeF3 – фторид железа (lll) 2Fe + 3Cl2 =to=> 2FeCl3 – хлорид железа (lll) 2Fe + 3Br2 =to=> 2FeBr3 – бромид железа (lll) Йод же, как наиболее слабый окислитель среди галогенов, окисляет железо лишь до степени окисления +2: Fe + I2 =to=> FeI2 – йодид железа (ll)
С водородомЖелезо с водородом не реагирует (с водородом из металлов реагируют только щелочные металлы и щелочноземельные): Взаимодействие со сложными веществамиВзаимодействие с кислотамиС кислотами-неокислителямиТак как железо расположено в ряду активности левее водорода, это значит, что оно способно вытеснять водород из кислот-неокислителей (почти все кислоты кроме h3SO4 (конц.) и HNO3 любой концентрации): Fe + h3SO4 (разб.) = FeSO4 + h3↑ Fe + 2HCl = FeCl2 + h3↑ Нужно обратить внимание на такую уловку в заданиях ЕГЭ, как вопрос на тему того до какой степени окисления окислится железо при действии на него разбавленной и концентрированной соляной кислоты. Правильный ответ – до +2 в обоих случаях. Ловушка здесь заключается в интуитивном ожидании более глубокого окисления железа (до с.о. +3) в случае его взаимодействия с концентрированной соляной кислотой. Взаимодействие с кислотами-окислителямиС концентрированными серной и азотной кислотами в обычных условиях железо не реагирует по причине пассивации. Однако, реагирует с ними при кипячении: Fe + 6h3SO4 = ot=> Fe2(SO4)3 + 3SO2 + 6h3O Fe + 6HNO3 =ot=> Fe(NO3)3 + 3NO2 + 3h3O Обратите внимание на то, что разбавленная серная кислота окисляет железо до степени окисления +2, а концентрированная до +3. Коррозия (ржавление) железаНа влажном воздухе железо весьма быстро подвергается ржавлению: 4Fe + 6h3O + 3O2 = 4Fe(OH)3 С водой в отсутствие кислорода железо не реагирует ни в обычных условиях, ни при кипячении. Реакция с водой протекает лишь при температуре выше температуры красного каления (>800 оС). т.е.: scienceforyou.ru
www.kontren.narod.ru Медь Свойства. |Соединения меди(I)
Многие соединения меди(I) имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди(I) все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu2O имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию: 2Cu+(водн.) → Cu2+(водн.) + Cu(тв.) В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]− устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I): CuCl(тв.) + Cl−(водн.) → [CuCl2]− (водн.) Хлорид меди(I) — белое нерастворимое твёрдое вещество. Как и другие галогениды меди(I), он имеет ковалентный характер и более устойчив, чем галогенид меди (II). Хлорид меди(I) можно получить при сильном нагревании хлорида меди(II): CuCl2(тв.) → 2CuCl(тв.) + Cl2(г.)Ионы меди окрашивают пламя в зелёный цвет Образует неустойчивый комплекс с CO CuCl+CO → Cu(CO)Cl разлагающийся при нагревании Другой способ его получения заключается в кипячении смеси хлорида меди(II) с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение — комплексный дихлорокупрат(I)-ион [CuCl2]−. При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I). Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(Nh4)2]+. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение. Аналитическая химия меди * Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода. * В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически. * Микроколичества меди в растворах определяют кинетическими методами. Применение В электротехнике Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C 0,01724-0,0180 мкОм·м[4]), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Присутствие в меди 0,02 % алюминия снизит ее электрическую проводимость почти на 10 %.[5] Теплообмен Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления. Для производства труб В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 , а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара. Сплавы на основе меди В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз. Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30-40 кгс/мм² у сплавов и 25-29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не принимают термической обработки, и их механические свойства и износостойкость определяются химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900-12000 кгс/мм² ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевые сплавы используются для чеканки разменной монеты. Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости. Медь является важным компонентом твёрдых припоев - сплавов с температурой плавления 590-880 градусов Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно, из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей Сплавы, в которых медь значима Дюраль (дюралюминий) определяют, как сплав алюминия и меди (меди в дюрали 4,4 %). Ювелирные сплавы В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям. Соединения меди Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов, и батарей. Другие сферы применения Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006 .Прогнозируемым новым массовым применением меди обещает стать ее применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека. Биологическая роль Продукты богатые медью.Метаболизм меди у человека. Поступление в энтероцит с помощью транспортёра CMT1, перенос с помощью ATOX1 в сеть транс-Гольджи, при росте концентрации — высвобождение с помощью АТФ-азы ATP7A в воротную вену. Поступление в гепатоцит, где ATP7B нагружает ионами меди белок церулоплазмин, а избыток выводит в желчь.Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день. Токсичность Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка».В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта.Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[9]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде. Общее число лиц, поражённых заболеванием, например, в США, составляет ок. 35 000 человек, то есть 0,01 % от общего числа водопользователей. Бактерицидность Бактерицидные свойства меди и её сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью[10] (агентство подчёркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выражено бактерицидное действие поверхностей из меди (и ее сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/h2N1 (т. н. «свиной грипп») Органолептические свойства Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2-10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди. Производство, добыча и запасы меди Мировая добыча меди в 2000 году составляла около 15 млн т., a в 2004 году — около 14 млн т. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т., из них 687 млн т. подтверждённые запасы , на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов . Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн. Основными производителями меди в России являлись:Компания тыс. тонн %Норильский никель 425 45 %Уралэлектромедь 351 37 %Русская медная компания 166 18 % К указанным производителям меди в России в 2009 году присоединился Холдинг «Металлоинвест», выкупивший права на разработку нового месторождения меди «Удоканское». Мировое производство меди в 2007 году составляло [17] 15,4 млн т, а в 2008 году — 15,7 млн т. Лидерами производства были: 1. Чили Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.), 2. Соединённые Штаты Америки США (1,170/1,310), 3. Перу Перу (1,190/1,220), 4. Китайская Народная Республика Китай (0,946/1,000), 5. Австралия Австралия (0,870/0,850), 6. Россия Россия (0,740/0,750), 7. Индонезия Индонезия (0,797/0,650), 8. Канада Канада (0,589/0,590), 9. Замбия Замбия (0,520/0,560), 10. Казахстан Казахстан (0,407/0,460), 11. Польша Польша (0,452/0,430), 12. Мексика Мексика (0,347/0,270). Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т. Способы добычи Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Самый большой самородок был найден в Северной Америке, а его вес составлял 420 тонн.[источник не указан 296 дней] Наверняка медь была первым металлом, с которым познакомились древние люди[источник не указан 296 дней]. Первые свои орудия делали они из кремниевой и железной руды, из меди, и уже потом научились изготовлять их из бронзы и железа. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах.Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди: 2CO + (CuOH)2CO3 \\mathrm{\\xrightarrow{\\Delta}}3CO2 + 2Cu + h3O. Добычу меди называют[кто?] прабабушкой металлургии. Её добыча и выплавка были налажены еще в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н. э.). Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди.На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае.В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров.Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды обнаружено на севере Читинской области.По объёму мирового производства и потребления медь занимает третье место после железа и алюминия. Интересные факты * В Японии медным трубопроводам для газа в зданиях присвоен статус «сейсмостойких». * Инструменты, изготовленные из меди и её сплавов не создают искр, а потому применяются там, где существуют особые требования безопасности (огнеопасные, взрывоопасные производства). * В организме взрослого человека содержится до 80 г меди. * Польские учёные установили, что в тех водоёмах, где присутствует медь, карпы отличаются крупными габаритами. В прудах или озёрах, где меди нет, быстро развивается грибок, который поражает карпов. * Поскольку медь не накапливается в организме, а выводится вместе с продуктами метаболизма, человеку ежедневно необходимо получать в составе диеты ок. 2 мг меди. obzor-novostei.ru свойства, получение, применение :: SYL.ruКак вам известно, в химии существует четыре класса неорганических соединений. Веществ, представляющих каждый из них, очень много, но лидирующее положение, несомненно, занимают оксиды. У одного химического элемента может быть сразу несколько разных бинарных соединений с кислородом. Такое свойство имеет и медь. У нее существует три оксида. Давайте рассмотрим их детальнее. Оксид меди (I)Его формула - Cu2O. В некоторых источниках данное соединение могут называть гемиоксидом меди, оксидом димеди или закисью меди. Свойства Является кристаллическим веществом, имеющим коричнево-красный цвет. Этот оксид не растворяется в воде и этиловом спирте. Может плавиться, не разлагаясь, при температуре чуть больше 1240оС. Данное вещество не взаимодействует с водой, но может переводиться в раствор, если участниками реакции с ним будут концентрированные хлоровородная кислота, щелочь, азотная кислота, гидрат аммиака, соли аммония, серная кислота. Получение оксида меди (I) Его можно получить, нагрев металлическую медь, или в такой среде, где кислород имеет малую концентрацию, а также в токе некоторых оксидов азота и вместе с оксидом меди (II). Кроме того, он может стать продуктом реакции термического разложения последнего. Оксид меди (I) получится и в том случае, если нагреть сульфид меди (I) в токе кислорода. Есть и другие, более сложные способы его получения (например, восстановление одного из гидроксидов меди, ионный обмен любой соли одновалентной меди с щелочью и т.п.), но их практикуют только в лабораториях. Применение Нужен в качестве пигмента, когда окрашивают керамику, стекло; компонента красок, которые защищают подводную часть судна от обрастания. Используется также как фунгицид. Без него не обходятся и меднозакисные вентили. Оксид меди (II)Его формула - CuO. Во многих источниках может встречаться под названием окиси меди. Свойства Это высший оксид меди. Вещество имеет вид черных кристаллов, которые почти не растворяются в воде. Взаимодействует с кислотой и при этой реакции образует соответствующую соль двухвалентной меди, а также воду. При его сплавлении с щелочью продукты реакции представлены купратами. Разложение оксида меди (II) происходит при температуре около 1100оС. Аммиак, монооксид углерода, водород и уголь способны извлекать из этого соединения металлическую медь. Получение Его можно получить при нагревании металлической меди в воздушной среде при одном условии - температура нагревания должна быть ниже 1100оС. Также оксид меди (II) может получиться, если нагреть карбонат, нитрат, двухвалентный гидроксид меди. Применение С помощью данного оксида окрашивают в зеленый или синий цвет эмаль и стекло, а также производят медно-рубиновую разновидность последнего. В лаборатории этим оксидом обнаруживают восстановительные свойства веществ. Оксид меди (III)Его формула - Cu2O3. Имеет традиционное название, которое звучит, наверное, немного необычно - окисел медь. Свойства Имеет вид красных кристаллов, не растворяющихся в воде. Разложение этого вещества происходит при температуре 400оС, продукты данной реакции - оксид меди (II) и кислород. Получение Его можно получить, окисляя двухвалентный гидроксид меди с помощью пероксидисульфата калия. Необходимое условие реакции - щелочная среда, в которой она должна происходить. Применение Данное вещество само по себе не используется. В науке и промышленности более широкое распространение находят продукты его разложения - оксид меди (II) и кислород. ЗаключениеВот и все оксиды меди. Их несколько из-за того, что медь имеет переменную валентность. Существуют и другие элементы, у которых есть по несколько оксидов, но о них поговорим в другой раз. www.syl.ru Соединения меди | Дистанционные уроки18-Ноя-2012 | Один Комментарий | Лолита Окольнова Медь относится к d-элементам.
Как и все d-элементы, соединения меди ярко окрашены.
Так же как у хрома, у меди наблюдается провал электронов — с s-орбитали на d-орбиталь
Электронное строение атома:
Соответственно, существуют 2 характерные степени окисления меди: +2 и +1.
Простое вещество: металл золотисто-розового цвета. Оксиды меди: Сu2O оксид меди (I) \ оксид меди 1 — красно-оранжевого цвета СuO оксид меди (II) \ оксид меди 2 — черного цвета. Другие соединения меди Cu(I), кроме оксида, неустойчивы. Соединения меди Cu(II) — во-первых, стабильны, во-вторых, голубого или зеленоватого цвета.
Еще одно окрашенное соединение меди — сульфид меди (II) — осадок черного цвета.
Медь, в отличие от других элементов, стоит в ряду напряжений после водорода, поэтому не выделяет его из кислот:
Пример задачи ЕГЭ С2 вариант 1:
Нитрат меди прокалили, полученный твёрдый осадок растворили в серной кислоте. Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в азотной кислоте.
2Сu(NO3)2 → 2CuO↓ +4 NO2↑ + O2↑
Твердый осадок — оксид меди (II).
CuO + h3S → CuS↓ + h3O
Сульфид меди (II) — осадок черного цвета.
«Подвергли обжигу» — значит, произошло взаимодействие с кислородом. Не путайте с «прокаливанием». Прокалить — нагреть, естественно, при высокой температуре.
2СuS + 3O2 = 2CuO + 2SO2
Твердый остаток — это СuO — если сульфид меди прореагировал полностью, СuO + CuS — если частично.
СuO + 2HNO3 = Cu(NO3)2 + h3O
CuS + 2HNO3 = Cu(NO3)2 + h3S возможна так же другая реакция:
СuS + 8HNO3 = Cu(NO3)2 + SO2 + 6NO2 + 4h3O
Пример задачи ЕГЭ С2 вариант 2:
Медь растворили в концентрированной азотной кислоте, полученный газ смешали с кислородом и растворили в воде. В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия.
В результате реакции с азотной кислотой образуется Сu(NO3)2, NO2 и O2.
NO2 смешали с кислородом — значит, окислили: 2NO2 + 5O2 = 2N2O5. Cмешали с водой: N2O5 + h3O = 2HNO3.
ZnO + 2HNO3 = Zn(NO3)2 + 2h3O
Zn(NO3)2 + 4NaOH = Na2[Zn(OH)4] + 2NaNO3
Еще на эту тему:Обсуждение: "Соединения меди"(Правила комментирования)distant-lessons.ru |
|
||||||||||||||||||
|
|
||||||||||||||||||
|







 Почему зеленеют медные монеты? Медь в присутствии воды взаимодействует с углекислым газом воздуха, образуется СuCO3 — вещество зеленого цвета.
Почему зеленеют медные монеты? Медь в присутствии воды взаимодействует с углекислым газом воздуха, образуется СuCO3 — вещество зеленого цвета.