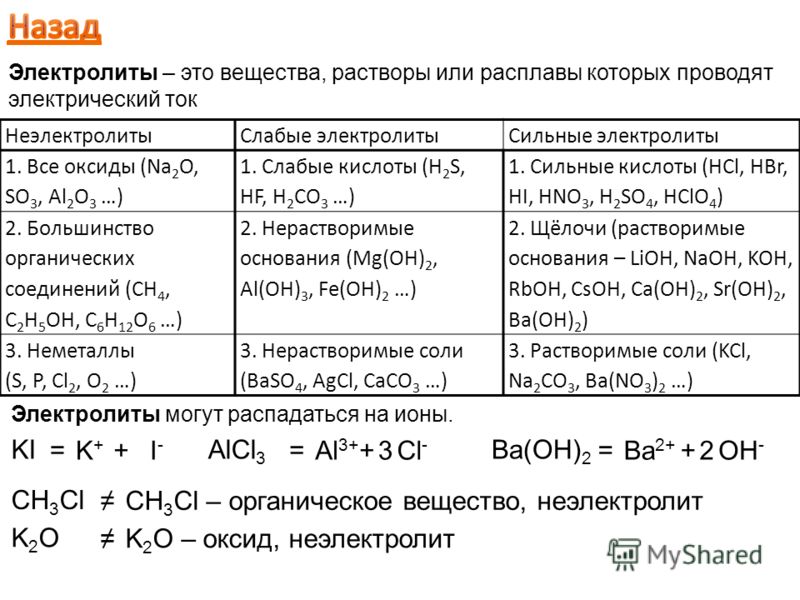
Содержание
Сибирские ученые создают твердые электролиты
Ученые из Института химии твердого тела и механохимии СО РАН разрабатывают, изготавливают и тестируют твердые электролиты — вещества, обладающие высокой ионной проводимостью, несмотря на свою кристаллическую природу. В перспективе из них можно будет делать твердотельные аккумуляторы и суперконденсаторы, которые сейчас активно разрабатываются во всем мире. Новосибирск — один из трех крупнейших российских центров, где занимаются подобными исследованиями (еще два — в Черноголовке и на Урале).
«Обычно мы привыкли к тому, что твердые вещества не являются проводниками ионов, — поясняет заведующий лабораторией неравновесных твердофазных систем ИХТТМ СО РАН доктор химических наук Николай Фавстович Уваров. — На самом деле, существуют такие каркасные структуры, в которых ионы могут двигаться быстрее, чем в жидкостях — эти соединения и являются твердыми электролитами».
Лаборатория оснащена оборудованием для исследования электрохимических и электрофизических характеристик твердых электролитов, а также прессом, который позволяет получать такие вещества в виде плотных керамик. «У нас есть приборы для изучения тонких явлений на границах раздела фаз, на границах зерен. В результате мы выбираем наиболее перспективные материалы, чтобы потом использовать их в твердотельных электрохимических устройствах», — комментирует Николай Уваров. Кстати, недавний лауреат Нобелевской премии по химии Джон Гуденаф также проводил исследования твердых электролитов и предложил некоторые из них с разными структурами.
В таких боксах собираются аккумуляторы
«Наша лаборатория специализируется на изучении композиционных твердых электролитов, — рассказывает Николай Уваров. — Например, мы берем электролит с низкой проводимостью, добавляем туда высокодисперсную добавку, спекаем — и получаем ионный проводник с хорошей проводимостью за счет того, что на границе раздела фаз образуются высокодефектные разупорядоченные состояния, обеспечивающие нужный нам эффект».
Электролиты, которые разрабатывают ученые, можно использовать в различных приборах — например, твердотельных аккумуляторах.
Еще одна сфера, где работают ученые — создание анодных и катодных твердотельных материалов для электрохимических устройств.«Мы можем собирать пробные образцы аккумуляторов и смотреть, что получилось — для этого у нас есть специальные боксы, устройства для сборки и тестирования», — отмечает Николай Уваров.
В числе проектов, которые ведутся в лаборатории — создание литий-ионных аккумуляторов с анодами и катодами, разработанными учеными ИХТТМ СО РАН. «Мы используем полностью отечественное сырье, с начала и до конца, — подчеркивает Николай Уваров. — И по своим параметрам, расчетным и полученными нами предварительно, эти аккумуляторы будут лучше, чем некоторые зарубежные аналоги.
«Наука в Сибири»
Фото Юлии Поздняковой
Твердые электролиты — презентация онлайн
Похожие презентации:
Ионные кристаллы
Химические источники тока. Электролиз
Стехиометрия и классификация твердых веществ
Топливный элемент
Электрохимические системы. Химические источники тока
Химическая связь в твердых телах. Классификация твердых тел по типу химической связи
Электролиз расплавов и растворов электролитов
Электрохимические процессы
Понятие электрохимии. Процессы на границе металл – раствор. Электродные потенциалы. Гальванические элементы. Уравнение Нернста
Химическая и электрическая работа систем с химическими реакциями. Устройства для проведения электрохимических реакций
ХИМИЯ ФУНКЦИОНАЛЬНЫХ
МАТЕРИАЛОВ
ТВЕРДЫЕ ЭЛЕКТРОЛИТЫ
Электролиты – вещества содержащие ионы и способные
за счет движения ионов проводить ток
Твердые диэлектрики
Ионная
Ковалентная
Ван-дер-Ваальсовая
Твердые электролиты (ионные проводники,
суперионники) – твердофазные (кристаллические,
поликристаллические или аморфные — стеклообразные)
материалы, в которых ионы одной из подрешеток обладают
достаточно большой подвижностью,
что обуславливает величины проводимости, сравнимые с
характеристиками сильных жидких электролитов
(~10-3-10 Ом-1см-1).
Открытие
Фарадей (1833 г.)
– PbF2 – выше 4500С – скачок проводимости
Проводимость
Типы точечных дефектов
Дефекты Френкеля
внутри кристалла
Е=10-20 эВ
ГЦК, ГПУ
Октаэдрическая 0,41R
Тетраэдрическая 0,22 R
Дефекты Шоттки
на поверхности
Е=0,9-1 эВ
Проводимость NaCl
Треугольное междоузлие,
через которое должен пройти ион Na+
Путь миграции иона
Na+ в NaCl
Зависимость проводимости
NaCl от температуры
Особенности твердых электролитов (ТЭЛ)
Типичные ТЭЛ
Условия существования суперионной проводимости
Разупорядоченность структуры
Нестехиометрический состав
Наличие вакансий
Наличие слоев или туннелей, подвижность ионной подрешетки,
• Низкая энергия активации
перескоков
• Большое число носителей заряда
• Легкая поляризуемость анионной
подрешетки
β-KAlO2
Типы ТЭЛ по проводимости: собственная разупорядоченность
α — AgI
ОЦК IAg+ — тетраэдрические
пустоты
β — AgI
ГПУ IAg+ — тетраэдрические
пустоты
Тубанд, Лоренц (1914)
T>1470C
Фазовый переход
α – AgI ↔ β — AgI
Типы ТЭЛ по проводимости: собственная разупорядоченность
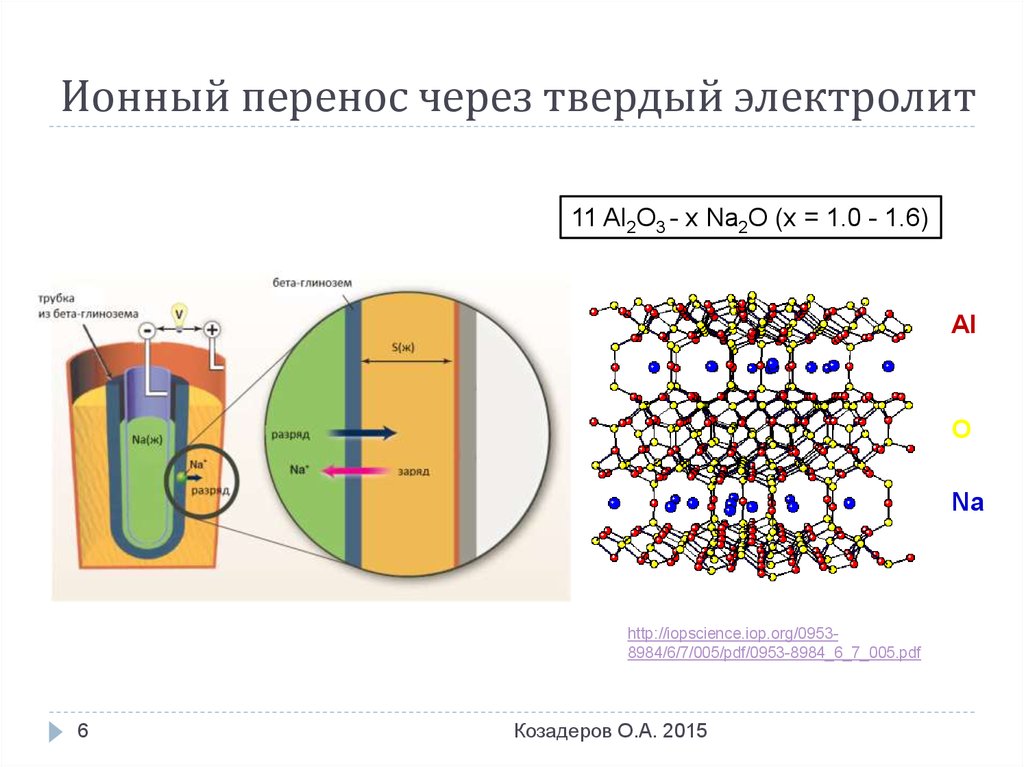
Типы ТЭЛ по проводимости: наличие слоев
β-Na глинозем
Натриево-серный
аккумулятор
Типы ТЭЛ по проводимости: наличие туннелей
Na1+xZr2P3-xSixO12 (NASICON) σ=1×10-1Ом-1×см-1 при 300 0С
Типы ТЭЛ по проводимости: примесные ионы
SrF2
Sr1-xLaxF2+x
ρ (Sr1-xLaxF2+x )>ρ(SrF2) на 6 порядков
Фазовые переходы ZrO2
Низкотемпературная моноклинная
модификация (P21/c),
КЧ(Zr) = 7, КЧ(О)=4; 3
Высокотемпературная кубическая
модификация (Fm3m), флюорит,
КЧ(Zr)=8, КЧ(О)=4
Zr — слишком маленький радиус
Фианит
Типы ТЭЛ по проводимости: кислородная проводимость
Стабилизированный иттрием оксид циркония
Применение ТЭЛ: датчики кислорода
Типы ТЭЛ по проводимости: ионная проводимость в стеклах
Si
O
Na
Кристаллическая
Аморфная
Стекло
Ионы – модификаторы способны к миграции при
наложении электрического поля
Химические источники тока
Гальванические
элементы
Аккумуляторы
Топливные
элементы
Гальванические элементы
Солевые батарейки
Анод: Zn-2e=Zn2+
Катод: 2MnO2+2h4O++2e=2MnO(OH)+2h3O
Zn + 2MnO2 + 2Nh5Cl → 2MnO (OH) +
[Zn (Nh4)2]Cl2
Щелочные (Alkaline) батарейки
Анод: Zn +2OH—2e=Zn(OH)2
Катод: 2MnO2+h3O+2e=Mn2O3+2OHZn + 2KOH + 2MnO2 + 2e− → ZnO +
2KOH + Mn2O3
ЭДС=Екатода-Еанода
Литиевые гальванические элементы
Тип
Напряжение
Вт*ч/кг
Li-MnO2
«CR»
3В
Li-FeS2
«FR»
1,4-1,6 В
Li-SOCl2
«E»
3,5 В
500-700
Li-SO2
2,85 В
250
Li-I2
2,8 В
Li-CuO
«GR»
1,5 В
Li-FeS
1,5-1,2 В
Li-FePO4
3,0-3,2 В
280
90160[11][12]
Аккумуляторы: Литий-ионный
Катод
Анод
Разряд
LiCo3+O2 – xLi+ – xē ↔ Li1-x Co(3+x)+О2
6C + xLi+ + xē ↔ LixC6
Заряженный аккумулятор
Разрядка аккумулятора
Разрядка аккумулятора
Переход ионов лития в графит
Разряженный аккумулятор
Перенос электронов внешним
источником тока (↑ ст.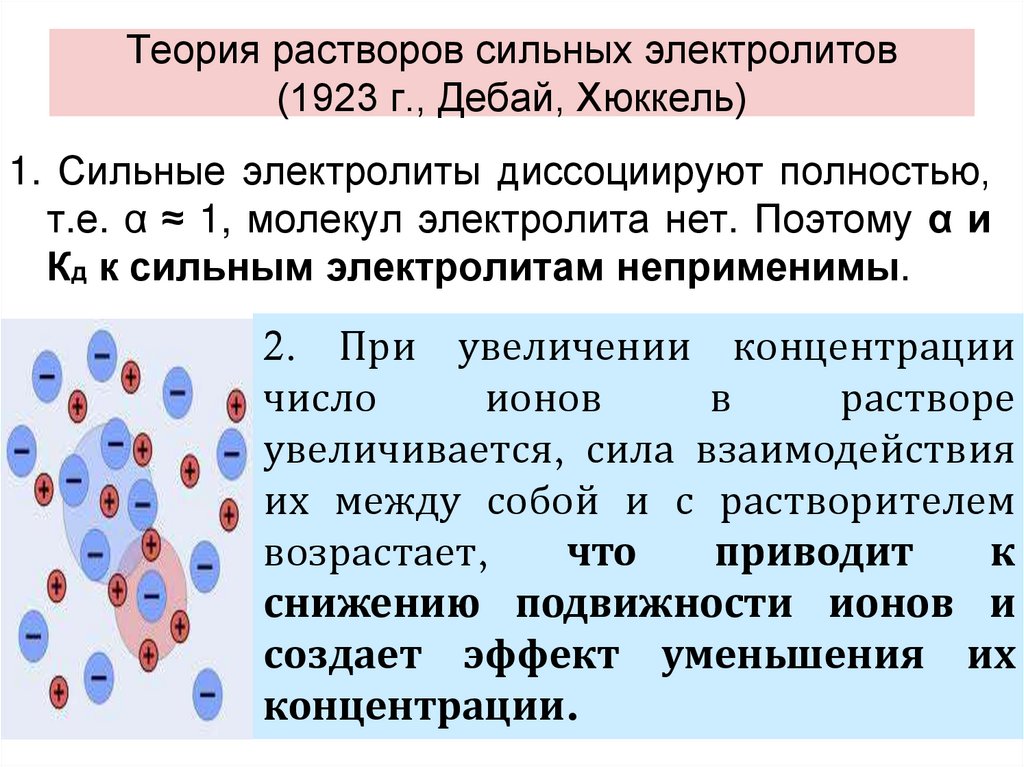
Устройство литий-ионного аккумулятора
Аккумуляторы
Катодные материалы
Катодные материалы: LiCoO2
Октаэдры CoO6 связаны попарно ребрами и образуют
отрицательно заряженные слои CoO2, которые
стабилизированы и экранированы слоями
октаэдрически координированных ионов лития,
которые могут свободно перемещаться в плоскости
слоя, обратимо интеркалироваться (внедрятся в слои)
и деинтеркалироваться в структуру (0 ≥ x ≥ 0.5) с
одновременным изменением формальной степени
окисления кобальта Co3+ / Co4+.
Емкость ~ 45 А-ч/кг
Напряжение ~ 3.7 В
Плотность энергии ~ 165 Вт-ч/кг
Число циклов зарядки-разрядки (500-1000)
Кобальт относительно дорог (по сравнению с Ti, Ni
и Mn) и токсичен
• Опасность возгорания при высокой
деинтеркаляции
• Применение – ноутбуки, телефоны
Катодные материалы: Li1-xMn2O4
• Структура дефектной шпинели
• Mn занимает октаэдрические
позиции, Li+ — тетраэдрические.
• Деинтекаляция лития – в пределах 0 ≥
x≥1
• Емкость ~ 36 А-ч/кг
• Напряжение ~ 3.
• Плотность энергии ~ 137 Вт-ч/кг
• Mn дешев и нетоксичен
• Присутствие Mn3+ вызывает ЯнТеллеровские искажения, что
уменьшает возможности
циклирования (300-700 циклов)
• Применение – электромобили,
медтехника
Катодные материалы: LiFePO4
• Структура оливина: ГПУ кислорода
Fe занимает октаэдрические позиции, P тетраэдрические.
• Большое количество циклов зарядкиразрядки (1000-2000)
• Емкость 50 Ач/кг
• Напряжение ~ 3.2 В
• Плотность энергии ~ 90-120 Вт-ч/кг
(самая низкая среди литий-ионных)
• Дешев и нетоксичен
• Безопасен даже при полной зарядке
(самый безопасный)
• Применение – электромобили,
электросамокаты и велосипеды,
источники бесперебойного питания
Джон Гуденаф (97 лет), Стэнли Уиттингем, Акира Ёсино
Нобелевская премия 2019
Разработка 1985
Аккумуляторы
Топливные элементы
Схема топливного элемента
Низкотемпературные топливные элементы
Высокотемпературные топливные
элементы
Щелочные
Водородные с Н+
мембраной
Метанольные Н+
мембраной
На расплавах
карбонатов
Твердоксидные
<1000
60-1200
60-1200
600-7000
800-10000
КОН
Поликислота
Поликислота
LiNaСO3,
LiKСO3
ZrO2+Y2O3
Реагенты
Н2, О2
Н2, О2
СН3ОН, О2
CН4, О2
CН4, О2
Ион-переносчик
ОН-
Н+
Н+
СO32-
O2-
Электроды
Pt
Pt
Pt
Kt: NiO,
An: Ni-Al, Ni-Cr
Лантанидные
перовскиты
Проблемы
Дорогой
катализатор
Отравление
катализатора,
нужен чистый
водород
Дорогой
катализатор
Отравление
катализатора,
нужен чистый
водород
Дорогой
катализатор
Отравление
катализатора,
нужен чистый
водород
Высокие
температуры
Высокие
температуры
КПД
До 70%
До 50%
До 50%
До 70%
До 70%
Рабочая
температура
Электролит
Материалы топливных ячеек
Материалы топливных ячеек
Космическая отрасль
Автомобилестроение
Применение топливных элементов
Источники
бесперебойного питания
Обеспечение
удаленных поселков
Зарядные устройства
English
Русский
Правила
Ученые открыли новый электролит для твердотельных литий-ионных аккумуляторов
В поисках идеального аккумулятора ученые преследуют две основные цели: создать устройство, способное хранить большое количество энергии и делать это безопасно.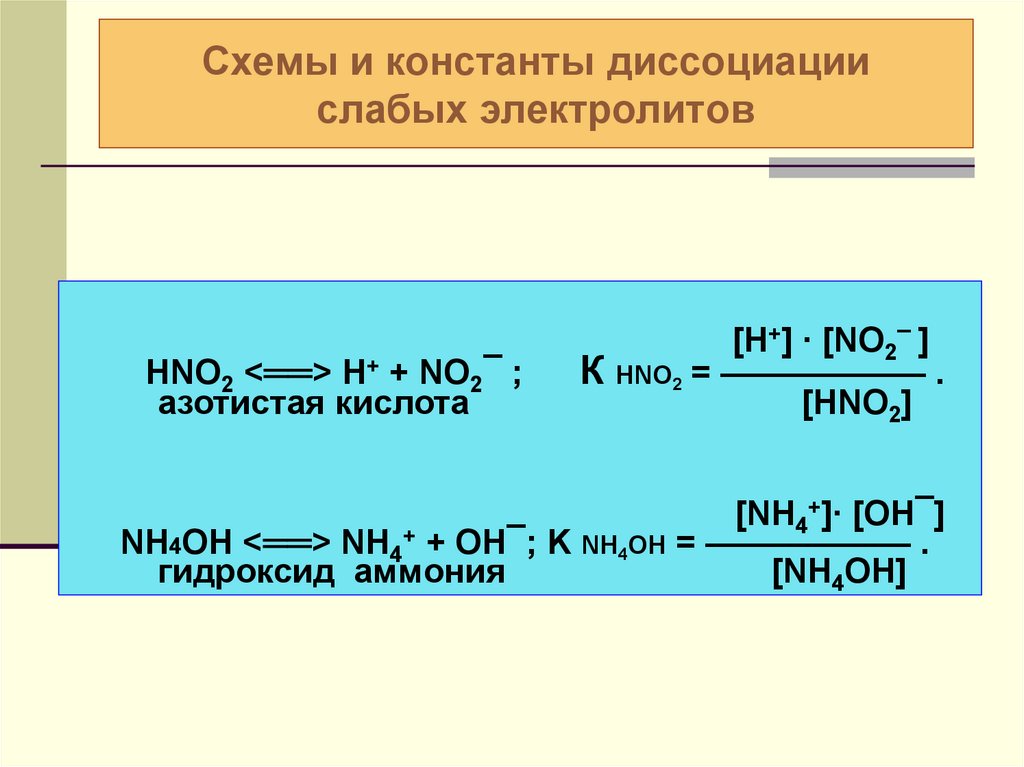
В результате твердотельные литий-ионные батареи, состоящие из полностью твердых компонентов, становятся все более привлекательными для ученых, поскольку они предлагают привлекательное сочетание более высокой безопасности и повышенной плотности энергии — именно столько энергии может хранить батарея. на заданный объем.
Исследователи из Университета Ватерлоо, Канада, которые являются членами Объединенного центра исследований в области хранения энергии (JCESR), со штаб-квартирой в Аргоннской национальной лаборатории Министерства энергетики США (DOE), обнаружили новый твердый электролит, который предлагает несколько важных преимущества.
Этот электролит, состоящий из лития, скандия, индия и хлора, хорошо проводит ионы лития, но плохо проводит электроны. Эта комбинация необходима для создания полностью твердотельной батареи, которая работает без существенной потери емкости в течение более ста циклов при высоком напряжении (выше 4 вольт) и тысяч циклов при промежуточном напряжении.
«Главная привлекательность твердотельного электролита заключается в том, что он не может загореться и позволяет эффективно размещать его в аккумуляторной ячейке; мы были рады продемонстрировать стабильную работу при высоком напряжении», — сказала Линда Назар, заслуженный профессор химии Университета Ватерлоо и давний член JCESR.
Текущие версии твердотельных электролитов в значительной степени сосредоточены на сульфидах, которые окисляются и разлагаются при напряжении выше 2,5 вольт. Следовательно, они требуют включения изолирующего покрытия вокруг материала катода, которое работает при напряжении выше 4 вольт, что ухудшает способность электронов и ионов лития перемещаться из электролита в катод.
«С сульфидными электролитами у вас есть своего рода головоломка — вы хотите электронно изолировать электролит от катода, чтобы он не окислялся, но вам по-прежнему требуется электронная проводимость в материале катода», — сказал Назар.
Хотя группа Назара не была первой, кто изобрел хлоридный электролит, решение заменить половину индия на скандий, основанное на их предыдущей работе, оказалось выигрышным с точки зрения более низкой электронной и более высокой ионной проводимости. «Хлоридные электролиты становятся все более привлекательными, потому что они окисляются только при высоких напряжениях, а некоторые из них химически совместимы с лучшими катодами, которые у нас есть», — сказал Назар. «Недавно сообщалось о нескольких из них, но мы разработали один с явными преимуществами».
Одним из химических ключей к ионной проводимости является пересекающаяся трехмерная структура материала, называемая шпинелью. Исследователи должны были сбалансировать два конкурирующих желания — загрузить шпинель как можно большим количеством ионов, несущих заряд, но также оставить участки открытыми для движения ионов. «Вы можете думать об этом, как о попытке устроить танец — вы хотите, чтобы люди пришли, но вы не хотите, чтобы было слишком много людей», — сказал Назар.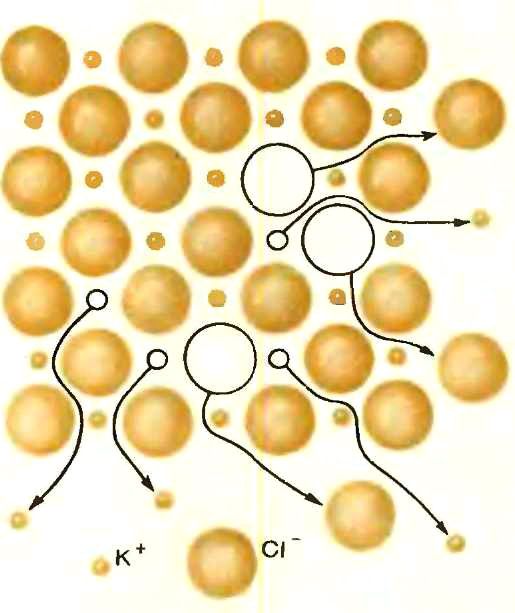
По словам Назар, идеальной ситуацией было бы, если бы половина мест в структуре шпинели была занята литием, а другая половина оставалась бы открытой, но она объяснила, что создать такую ситуацию сложно.
В дополнение к хорошей ионной проводимости лития, Назар и ее коллеги должны были убедиться, что электроны не могут легко перемещаться через электролит, чтобы вызвать его разложение при высоком напряжении. «Представьте себе игру в классики», — сказала она. «Даже если вы просто пытаетесь перепрыгнуть с первого квадрата на второй, если вы можете создать стену, которая затрудняет перепрыгивание электронов, в нашем случае, это еще одно преимущество этого твердого электролита. ».
Назар сказал, что пока неясно, почему электронная проводимость ниже, чем у многих хлоридных электролитов, о которых сообщалось ранее, но это помогает установить чистую поверхность раздела между материалом катода и твердым электролитом, факт, который в значительной степени отвечает за стабильную работу даже при высоких температурах.
Статья, основанная на исследовании «Высокая емкость, длительный срок службы 4-вольтовых керамических полностью твердотельных литий-ионных аккумуляторов на основе хлоридных твердых электролитов», появилась в онлайн-издании Nature Energy 9 от 3 января.0027 .
Среди других авторов статьи — аспирант Назара, Лайдонг Чжоу, член JCESR, ответственный за большую часть работы, а также Се Ён Ким, Чун Юэн Квок и Абдельджалил Ассуд, все из Университета Ватерлоо. Среди других авторов были Тонг-Тонг Зуо и профессор Юрген Янек из Университета Юстуса Либиха, Германия, и Цян Чжан из Окриджской национальной лаборатории Министерства энергетики.
Исследование финансировалось Управлением науки Министерства энергетики, Управлением фундаментальных энергетических наук при некоторой поддержке Канадского национального совета по науке и инженерным исследованиям.
Объединенный центр исследований в области хранения энергии (JCESR) , Центр инноваций в области энергетики Министерства энергетики США, представляет собой крупное партнерство, объединяющее исследователей из многих дисциплин для преодоления критических научных и технических барьеров и создания новой революционной технологии хранения энергии.
Аргоннская национальная лаборатория занимается поиском решений насущных национальных проблем в области науки и техники. Первая в стране национальная лаборатория, Аргонн, проводит передовые фундаментальные и прикладные научные исследования практически во всех научных дисциплинах. Исследователи Аргонны тесно сотрудничают с исследователями из сотен компаний, университетов, а также федеральных, государственных и муниципальных учреждений, чтобы помочь им решить их конкретные проблемы, укрепить научное лидерство Америки и подготовить нацию к лучшему будущему.
Управление науки Министерства энергетики США является крупнейшим сторонником фундаментальных исследований в области физических наук в Соединенных Штатах и работает над решением некоторых из самых насущных проблем нашего времени. Для получения дополнительной информации посетите https://energy.gov/science.
Гибкие твердые электролиты на основе Li6.4La3Zr1.4Ta0.6O12 толщиной 20 мкм для полностью твердотельных литиевых батарей
ли металл. Однако толстый слой электролита и жесткая природа, а также плохой межфазный контакт являются огромными препятствиями для его применения в полностью твердотельных литиевых батареях. Здесь ультратонкий гибкий Li 6,4 La 3 Zr 1,4 Ta 0,6 O 12 — Твердый электролит на основе (LLZTO-) с содержанием LLZTO 90% масс.
1. Введение
Литий-ионные аккумуляторы
являются доминирующими устройствами для хранения энергии из-за высокой плотности энергии, низкой скорости саморазряда и экологичности.
Чтобы существенно преодолеть эти проблемы, все больше внимания привлекают полностью твердотельные литиевые батареи, использующие твердые электролиты, т. е. , полимерные электролиты или неорганические керамические электролиты, что демонстрирует возможный потенциал для высокоплотных и безопасных литий-металлических батарей [ 10–16]. Однако из-за выделения кислорода из оксидного катода при высоком напряжении полимерные электролиты, как правило, разлагаются, а также ухудшаются межфазные свойства [17, 18]. В то время как для неорганических твердых электролитов толстый слой электролита, жесткая природа и плохой межфазный контакт являются большими проблемами для их практического применения [10, 19].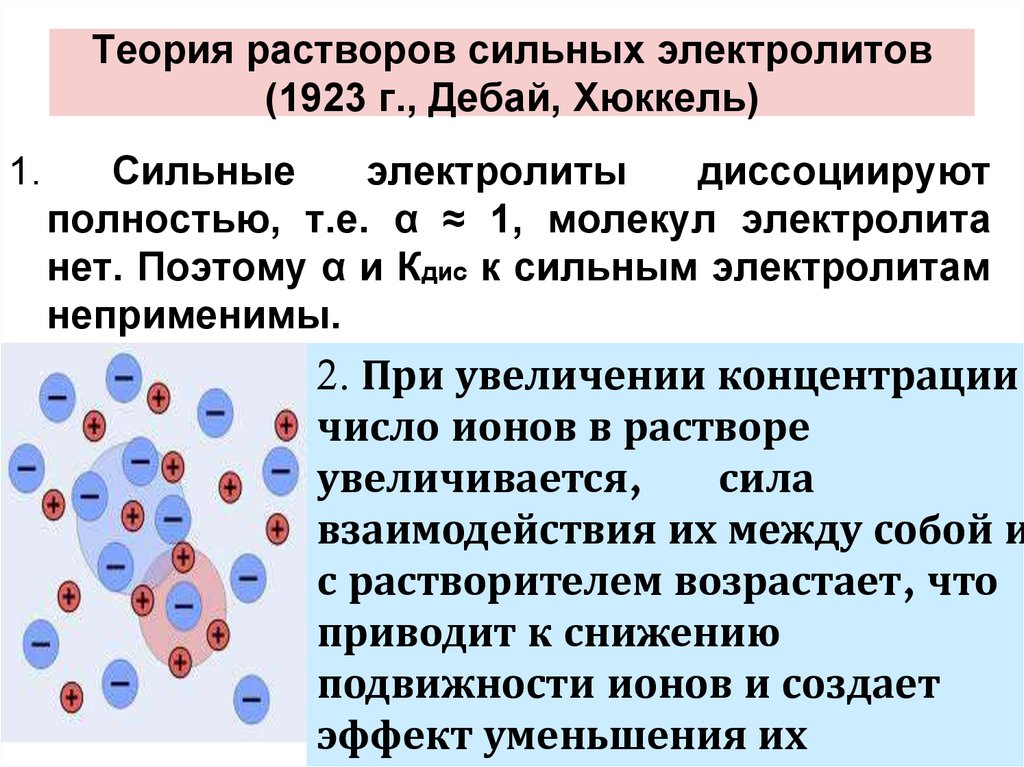
Приготовление твердого электролита полимер-в-керамике является одной из наиболее перспективных стратегий для решения вышеуказанных проблем за счет введения гибкого полимерного компонента при сохранении превосходной электрохимической стабильности, механического модуля и термической стабильности неорганических электролитов [22–25]. Чен и др. [26] и Huo et al. [27] продемонстрировали мк м твердого электролита полимер-в-керамике с 80 % масс. гранатовой керамики и ~60 мк м твердого электролита полимер-в-керамике с 80 об.% Li 6,4 La 3 Zr 1,4 Ta 0,6 O 12 частицы активированы введением ПЭО полимерной матрицы соответственно. Полимерная матрица на основе ПЭО считается многообещающим кандидатом из-за превосходной межфазной совместимости с литиевым анодом [28]. Однако из-за меньшей прочности ПЭО [29] полимер-керамический твердый электролит на основе граната хрупко разрушается за счет уменьшения их толщины при высоком содержании неорганических веществ.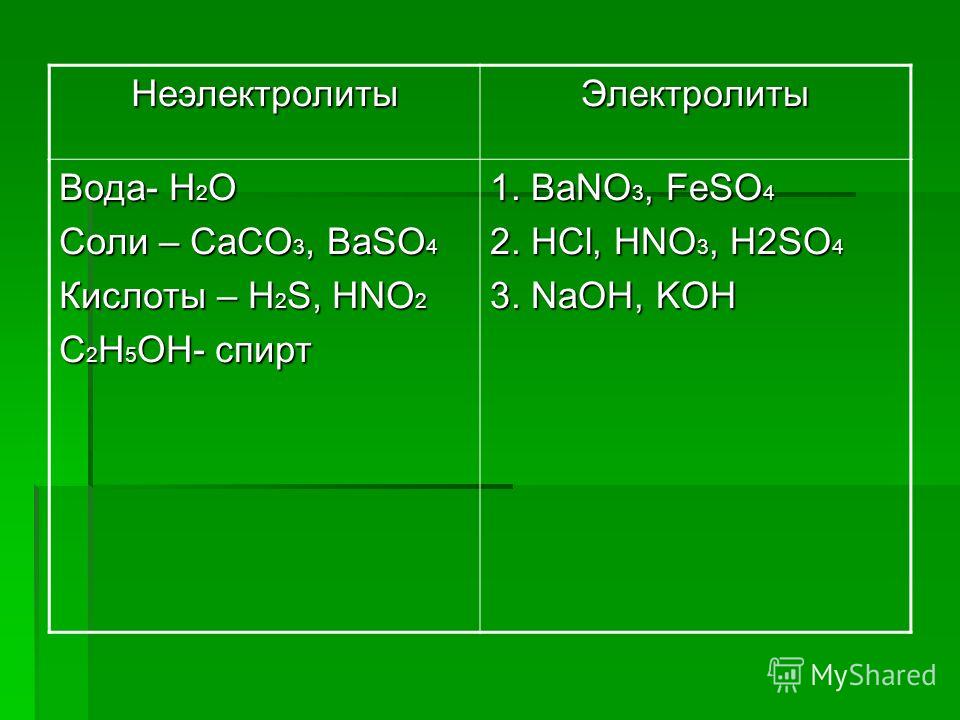
В данной работе мы разрабатываем трехмерную (3D) сшитую проводящую сеть для ультратонких и гибких Li 6,4 La 3 Zr 1,4 Ta 0,6 O 12 — на основе (LLZTO) твердый электролит с содержанием LLZTO 90 % масс., толщиной 20 мкм мкм и сверхвысокой ионной проводимостью 41,21 мСм при 30°C. Кроме того, интегрированный интерфейс электролит/катод создается с помощью in situ , формирующего и отверждающего пленку на основе LLZTO на поверхности катода, что обеспечивает тесный контакт электролит/катод. В результате родственные Li||LiFePO 4 Пакетная ячейка демонстрирует превосходные характеристики скорости и циклическую стабильность.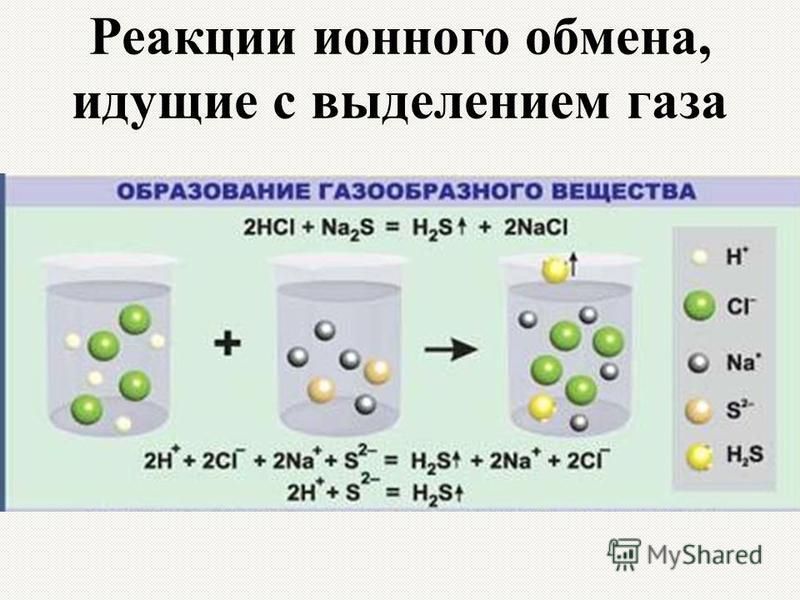
2. Материалы и методы
2.1. Подготовка материала
LI 6,4 LA 3 ZR 1,4 TA 0,6 O 12 (HF-KEJIN (Dynanonic) сушили при 100°C в вакуумной печи в течение 12 часов для удаления влаги и хранили в перчаточном боксе из аргона. Диглицидиловый эфир поли(этиленгликоля) (PEGDE, M n из 500), диэтилентриамин (DETA) и диметиловый эфир полиэтиленгликоля (PEGDME, M n из 250) были приобретены у Aladdin. Литиевые фольги толщиной 50 мкм мкм были приобретены у China Energy Lithium Co., Ltd.
2.2. Приготовление пленки твердого электролита
Сначала ПЭГДЭ, ПЭГДМЭ, ДЭТА, LiTFSI и LLZTO смешивали без растворителя, и после измельчения в течение 2 ч получали пластилиновую смесь для обеспечения однородной смеси между большим количеством частиц LLZTO и небольшим количеством жидкого прекурсора. В частности, 90 мас.% LLZTO использовали при молярном соотношении 5 : 10 : 2 для ПЭГДЭ, ПЭГДМЭ и ДЭТА.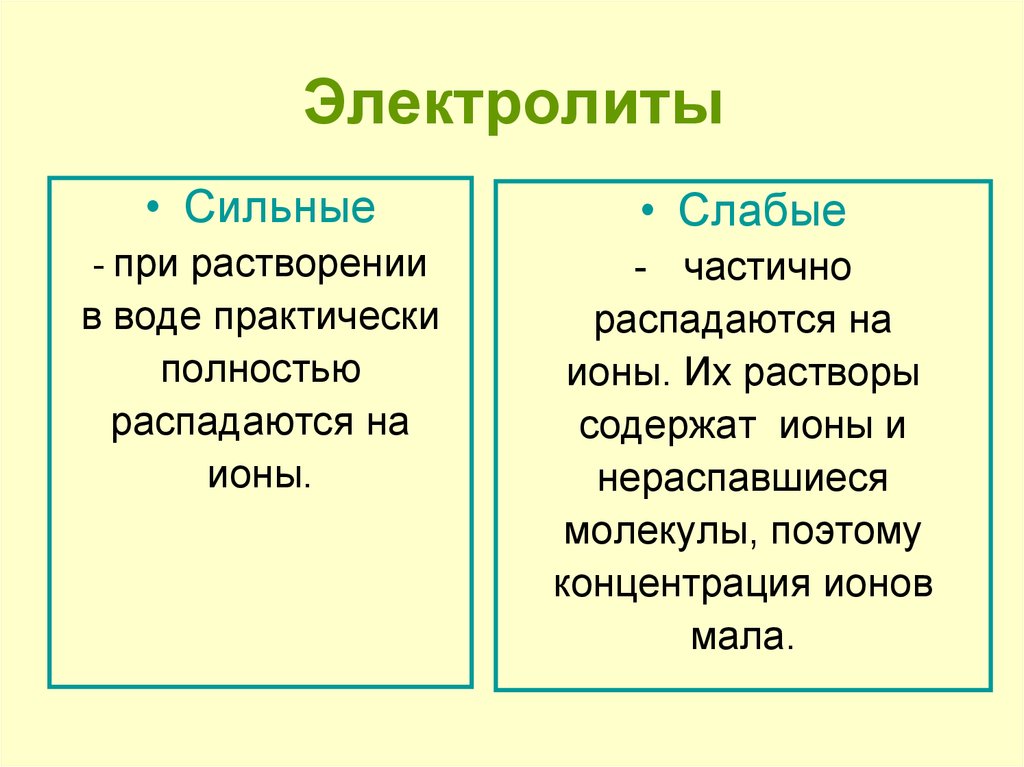
2.3. Характеристика материала
Кристаллическая структура образца была охарактеризована с помощью рентгеноструктурного анализа (XRD, D8 Advance, Bruker) с излучением Cu Kα нм в диапазоне 10°-80°. Инфракрасная спектроскопия с преобразованием Фурье (FTIR) была получена на Netzsch X70. Термогравиметрический (ТГ) анализ проводили с помощью Diamond TG/DTA при скорости нагрева 10°C мин -1 от 50 до 600°C в атмосфере аргона.
2.4. Электрохимические измерения
Спектроскопия электрохимического импеданса (EIS), вольтамперометрия с линейной разверткой (LSV) и поляризация постоянного тока были выполнены на электрохимической станции Solartron 1470E для оценки ионной проводимости, электрохимического окна и числа переноса литий-иона пленки на основе LLZTO. соответственно. В ячейке из нержавеющей стали (НС)|пленка на основе ЛЛЗТО|СС регистрировали спектры импеданса в диапазоне частот от 1 МГц до 10 Гц и амплитуде потенциала 10 мВ. Ионная проводимость рассчитывается по уравнению , где , , и – толщина (см) электролита, полное сопротивление электролита ( Ом ) и эффективной площади контакта (см 2 ) между электродами из нержавеющей стали и электролитом соответственно.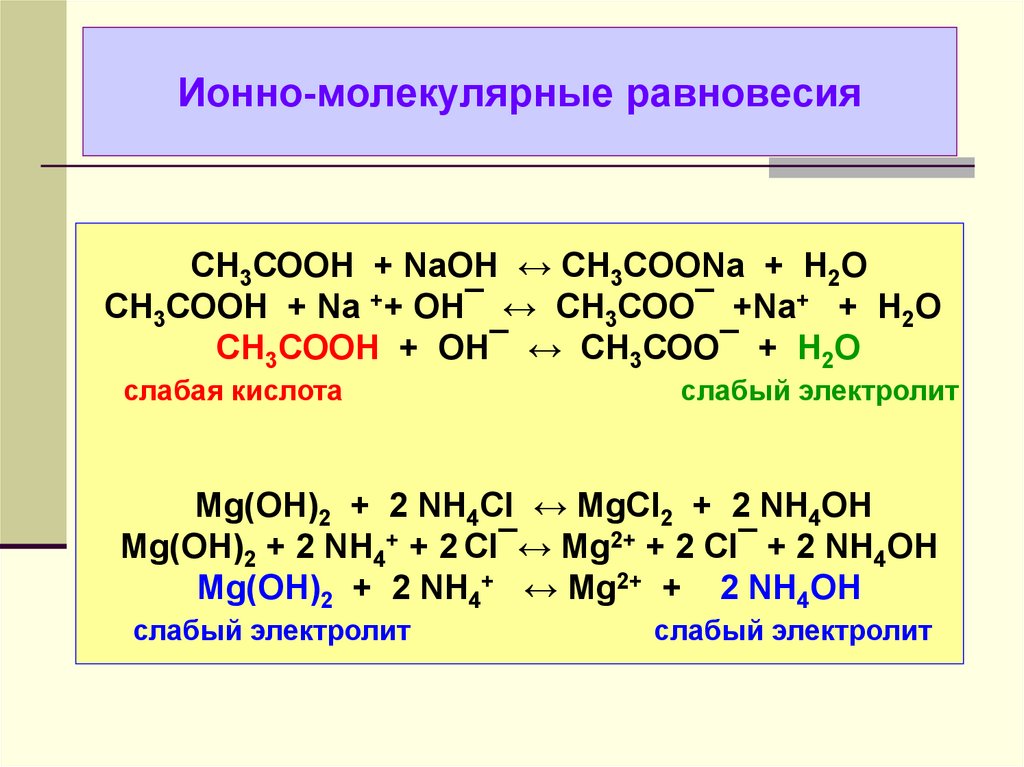

LiFePO 4 , поли(винилиденфторид) (PVDF), LiTFSI и Super P с массовым соотношением 70 : 12 : 8 : 10 были нанесены на алюминиевую фольгу с N -метил-2-пирролидоном в качестве растворителя для изготовления композитного катода. Пленочный элемент на основе Li|LLZTO|LiFePO 4 () был собран для проверки циклических характеристик аккумуляторной системы LAND CT2001A (Wuhan Rambo Testing Equipment Co, Ltd.) с гальваностатическим зарядом и разрядом между 2,6 и 3,9.В при 60°С. Массовая загрузка активного материала LiFePO 4 составляет ~3 мг см -2 , а скорость тока устанавливается равной 1 мА г -1 .
3. Результаты и обсуждение
Процедура синтеза твердого электролита на основе ЛЛЗТО представлена на рис. 1(а). Порошок LLZTO, диглицидиловый эфир полиэтиленгликоля (PEGDE), диэтилентриамин (DETA), бис(трифторметансульфонил)имид лития (LiTFSI) и диметиловый эфир полиэтиленгликоля (PEGDME) смешивали без растворителя с получением пластилиновой смеси с высокая пластичность (показана на видео S1).
Используемый порошок LLZTO гранатового типа с размером частиц 5 ~ 10 мкм мкм имеет кубическую фазовую структуру (рис.

Благодаря трехмерной ионно-проводящей сетке пленка на основе LLZTO обладает значительной ионной проводимостью См см -1 при 30°C, а расчетная энергия активации составляет 0,31 эВ (рис. 2(а)). Ионная проводимость и соответствующие графики Найквиста для пленки на основе LLZTO при различных температурах показаны в таблице S1 и на рисунке S7 соответственно.

Оценены циклические характеристики пленки на основе Li|LLZTO|Li симметричной ячейки, демонстрирующей стабильность при циклировании в течение более 2000 ч при низком перенапряжении 10 мВ при 0,1 мА см -2 (рис. 3(а)). Стабильное перенапряжение во время циклирования также указывает на превосходную межфазную совместимость между металлическим литием и пленкой на основе LLZTO. Небольшие колебания перенапряжения в основном возникают из-за колебаний температуры измерения из-за неконтролируемых внешних факторов. Более того, симметричная ячейка на основе пленки Li|LLZTO|Li демонстрирует лишь незначительное увеличение импеданса во время циклирования (рис.

4. Выводы
Таким образом, гибкая пленка на основе LLZTO толщиной 20 мкм и толщиной м была успешно изготовлена без использования растворителей. Содержание порошка ЛЛЗТО в пленке на основе ЛЛЗТО достигает 90 мас.%. Пленка на основе LLZTO демонстрирует сверхвысокую ионную проводимость 41,21 мСм при 30 °C, превосходную термическую стабильность, негорючесть и широкое электрохимическое окно, а также высокое число переноса лития 0,81. Между тем, симметричная ячейка на основе пленки Li|LLZTO|Li может стабильно работать в течение 2000 часов при 0,1 мА см -2 . Собранный пленочный элемент на основе Li|LLZTO|LiFePO 4 с интегрированной конструкцией электролит/катод демонстрирует стабильную циклическую работу, демонстрируя сохранение емкости на уровне 71,4% после 500 циклов при 0,1 °C. Более того, пакетный элемент на основе LLZTO обеспечивает превосходную гибкость и безопасность. Представленная сверхтонкая пленка на основе ЛЛЗТО имеет большой потенциал для практического применения в полностью твердотельных литиевых батареях.
Доступность данных
Все данные, представленные в статье, и вспомогательная информация доступны у соответствующего автора по обоснованному запросу.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Q.Y.G., F.L.X., and L.S. в равной мере внесли свой вклад в эту работу. Q.Y.G., F.L.X. и L.S. провел эксперименты, проанализировал данные и написал первоначальный проект. С.Г.Д., З.Ю.В. и М.К.Л. оказал помощь по сбору данных и представлению рисунков. X.Y.Y. предложил и курировал проект. Цинъя Го, Фанлинь Сюй и Линь Шэнь внесли равный вклад в эту работу.
Благодарности
Работа выполнена при поддержке Национальной ключевой программы исследований и разработок Китая (грант № 2018YFB0905400), Национального фонда естественных наук Китая (гранты № U1964205, U21A2075, 51872303 и 511), Ningbo S&T Innovation 2025 Major Special Программа (№ гранта 2019B10044, 2021Z122), Ключевая программа исследований и разработок провинции Чжэцзян Китая (Грант № 2022C01072) и Ассоциация содействия инновациям молодежи CAS (Y2021080).
Дополнительные материалы
Рисунок S1: сравнение толщины и содержания керамики в заявленной тонкой пленке оксида с твердым электролитом. Рисунок S2: (а) СЭМ-изображение частицы LLZTO. (b) Рентгенограмма частицы LLZTO. Рисунок S3: FTIR-спектры ПЭГДЭ, ДЭТА и отвержденной эпоксидной смолы ПЭГДЭ. Рисунок S4: оптическое изображение смеси ПЭГДЭ и ДЭТА до и после термического отверждения. Рисунок S5: (a) СЭМ-изображение сверху пленки на основе LLZTO без изостатического давления. (b) СЭМ-изображение поперечного сечения и (c) соответствующее EDS-картирование элемента La пленки LLZTO без изостатического давления. Рисунок S6: Рентгенограммы пленки на основе PEGDE и LLZTO. Рисунок S7: Графики Найквиста для пленки на основе LLZTO при разных температурах. Рисунок S8: кривая TG исходных коммерческих частиц LLZTO. Рисунок S9: спектроскопия электрохимического импеданса (ЭИС) пленки на основе Li|LLZTO|Li симметричной ячейки до циклирования и после 20, 50 и 100 циклов при 0,1 мА см -2 при 60°C. Рисунок S10: СЭМ-изображения верхней поверхности (а) нециклированного литиевого анода и (б) циклированного литиевого анода, извлеченного из пленки на основе Li|LLZTO|Li симметричной ячейки после 100 циклов при 0,1 мА см -2 .
Добавить комментарий