Характеристика калия. Строение калия. Соединения калия. Калия кислота
Оксид калия: формула, взаимодействие :: SYL.ru
В неорганической химии существует три основных класса соединений. Это кислоты, щелочи и оксиды. Кислота состоит из катиона водорода и аниона кислотного остатка. Щелочь - из катиона металла и гидроксильной группы. Об оксидах мы поговорим подробнее далее.
Что такое оксид?
Это соединение, состоящее из двух разных химических элементов, одним из которых является кислород. Вторым же может быть металл или неметалл. Количество атомов кислорода зависит от валентности второго химического элемента, входящего в состав соединения. Так, например, валентность калия равна одному, поэтому оксид калия будет содержать один атом кислорода и два атома калия. Валентность кальция равна двум, поэтому его оксид будет состоять из одного атома кислорода и одного атома кальция. Валентность фосфора равна пяти, поэтому его оксид состоит из двух атомов фосфора и пяти атомов кислорода.
В этой статье мы более подробно поговорим про оксид калия. А именно - о его физических и химических свойствах, о его применении в различных областях промышленности.
Оксид калия: формула
Так как валентность данного металла равна одному, а валентность кислорода - двум, то это химическое соединение будет состоять из двух атомов металла и одного атома Оксигена. Итак, оксид калия: формула - К2О.
Физические свойства
Рассматриваемый оксид обладает бледно-желтой окраской. Иногда он может быть и бесцветным. При комнатной температуре он обладает твердым агрегатным состоянием.
Температура плавления данного вещества равняется 740 градусам Цельсия.
Плотность составляет 2,32 г/см3.
При термическом разложении данного оксида образуется пероксид этого же металла и чистый калий.
Растворим в органических растворителях.
В воде не растворяется, а вступает в реакцию с ней.
Обладает высокой гигроскопичностью.
Химические свойства К2О
Данное вещество обладает типичными для всех основных оксидов химическими свойствами. Рассмотрим химические реакции данного оксида с различными веществами по порядку.
Реакция с водой
В первую очередь оно способно реагировать с водой с образованием в результате гидроксида данного металла.
Уравнение такой реакции выглядит следующим образом:
Зная молярную массу каждого из веществ, из уравнения можно сделать следующий вывод: из 94 граммов рассматриваемого оксида и 18 граммов воды можно получить 112 граммов калий гидроксида.
С другими оксидами
Кроме того, рассматриваемый оксид способен реагировать с диоксидом карбона (углекислым газом). При этом образуется соль - карбонат калия.
Уравнение реакции оксида калия и оксида карбона можно записать следующим образом:
Так, можно сделать вывод, что из 94 граммов рассматриваемого оксида и 44 граммов углекислого газа получается 138 граммов калий карбоната.
Также рассматриваемый оксид может вступать в реакцию с оксидом сульфура. При этом образуется другая соль - калий сульфат.
Взаимодействие оксида калия с оксидом сульфура можно выразить следующим уравнением:
Из него видно, что, взяв 94 грамма рассматриваемого оксида и 80 граммов оксида сульфура, можно получить 174 грамма сульфата калия.
Таким же образом К2О может реагировать и с другими оксидами.
Другой тип взаимодействия - реакции не с кислотными, а с амфотерными оксидами. В таком случае образуется не кислота, а соль. Примером такого химического процесса может служить взаимодействие рассматриваемого оксида с оксидом цинка.
Эту реакцию можно выразить следующим уравнением:
Из него видно, что при взаимодействии рассматриваемого оксида и оксида цинка образуется соль под названием калий цинкат. Если знать молярную массу всех веществ, то можно подсчитать, что из 94 граммов К2О и 81 грамма оксида цинка можно получить 175 граммов калий цинката.
Также К2О способен взаимодействовать с оксидом азота. При этом образуется смесь из двух солей: нитрата и нитрита калия. Уравнение этой реакции выглядит таким образом:
Если знать молярные массы веществ, можно сказать, что из 94 граммов рассматриваемого оксида и 92 граммов оксида нитрогена можно получить 101 грамм нитрата и 85 граммов нитрита.
Взаимодействие с кислотами
Самый распространенный случай - оксид калия + серная кислота = сульфат калия + вода. Уравнение реакции выглядит таким образом:
- К2О + h3SO4 = K2SO4 + Н2О
Из уравнения можно сделать вывод, что для получения 174 граммов сульфата калия и 18 граммов воды необходимо взять 94 грамма рассматриваемого оксида и 98 граммов серной кислоты.
Похожим образом происходит химическое взаимодействие между рассматриваемым оксидом и азотной кислотой. При этом образуется нитрат калия и вода. Уравнение этой реакции можно записать следующим образом:
- 2К2О + 4HNO3 = 4KNO3 + 2Н2О
Таким образом, из 188 граммов рассматриваемого оксида и 252 граммов азотной кислоты можно получить 404 грамма нитрата калия и 36 граммов воды.
По такому же принципу рассматриваемый оксид может реагировать и с другими кислотами. В процессе этого будут образовываться другие соли и вода. Так, к примеру, при реакции этого оксида с фосфорной кислотой получается фосфат и вода, с хлоридной кислотой - хлорид и вода и так далее.
К2О и галогены
Рассматриваемое химическое соединение способно реагировать и с веществами данной группы. К галогенам относятся простые соединения, состоящие из нескольких атомов одного и того же химического элемента. Это, например, хлор, бром, иод и некоторые другие.
Итак, хлор и оксид калия: уравнение:
В результате такого взаимодействия образуется две соли: хлорид и гипохлорит калия. Из 94 грамм рассматриваемого оксида и 70 грамм хлора получается 74 грамма хлорида калия и 90 грамм гипохлорита калия.
Взаимодействие с аммиаком
К2О способен реагировать с этим веществом. В результате такого химического взаимодействия образуется гидроксид и амид калия. Уравнение данной реакции выглядит следующим образом:
Зная молярные массы всех веществ, можно вычислить пропорции реагентов и продуктов реакции. Из 94 граммов рассматриваемого оксида и 17 граммов аммиака можно получить 56 граммов гидроксида калия и 55 граммов амида калия.
Взаимодействие с органическими веществами
Из органических химических веществ оксид калия взаимодействует с эфирами и спиртами. Однако эти реакции идут медленно и требуют специальных условий.
Получение К2О
Данное химическое вещество можно получать несолькими способами. Вот самые распространенные из них:
- Из нитрата калия и металлического калия. Эти два реагента нагревают, в результате чего образуется К2О и азот. Уравнение реакции выглядит следующим образом: 2KNO3 + 10К = N2 + 6К2О.
- Второй способ происходит в два этапа. Сначала происходит реакция между калием и кислородом, в результате чего образуется пероксид калия. Уравнение реакции выглядит так: 2К + О2 = К2О2. Далее пероксид обогащают калием, в результате чего и получают оксид калия. Уравнение реакции можно записать таким образом: К2О2 + 2К = 2К2О.
Использование К2О в промышленности
Наиболее часто рассматриваемое вещество используется в сельскохозяйственной промышленности. Данный оксид является одним из компонентов минеральных удобрений. Калий очень важен для растений, так как повышает их стойкость к различным заболеваниям. Также рассматриваемое вещество применяется в строительстве, так как может присутствовать в составе некоторых видов цемента. Кроме того, оно применяется в химической промышленности для получения других соединений калия.
www.syl.ru
Характеристика калия. Строение калия. Соединения калия
В этой статье будет дана характеристика калия с точки зрения физики и химии. Первая из этих наук изучает механические и внешние свойства веществ. А вторая - их взаимодействие друг с другом - это химия. Калий - девятнадцатый по счету элемент в таблице Менделеева. Он принадлежит к щелочным металлам. В этой статье будет рассмотрена и электронная формула калия, и его поведение с другими веществами и т. д. Это один из наиболее активных металлов. Наука, которая занимается изучением этого и других элементов - химия. 8 класс предусматривает изучение неорганических веществ и их свойств. Поэтому данная статья будет полезна школьникам. Итак, начнем.
Характеристика калия с точки зрения физики
Это простое вещество, которое при нормальных условиях находится в твердом агрегатном состоянии. Температура плавления составляет шестьдесят три градуса по шкале Цельсия. Закипает же данный металл, когда температура достигает семисот шестидесяти одного градуса по Цельсию. Рассматриваемое вещество обладает серебристо-белой окраской. Имеет металлический блеск.  Плотность калия составляет восемьдесят шесть сотых грамма на сантиметр кубический. Это очень легкий металл. Формула калия очень проста - он не формирует молекул. Данное вещество состоит из атомов, которые расположены близко друг к другу и имеют кристаллическую решетку. Атомная масса калия равняется тридцати девяти граммам на моль. Твердость его очень низкая - его можно легко порезать ножом, как сыр.
Плотность калия составляет восемьдесят шесть сотых грамма на сантиметр кубический. Это очень легкий металл. Формула калия очень проста - он не формирует молекул. Данное вещество состоит из атомов, которые расположены близко друг к другу и имеют кристаллическую решетку. Атомная масса калия равняется тридцати девяти граммам на моль. Твердость его очень низкая - его можно легко порезать ножом, как сыр.
Калий и химия
Начнем с того, что калий - химический элемент, который обладает очень высокой химической активностью. Даже хранить его на открытом воздухе нельзя, так как он моментально начинает реагировать с окружающими его веществами. Калий - химический элемент, который относится к первой группе и четвертому периоду таблицы Менделеева. Он обладает всеми свойствами, которые характерны для металлов.
Взаимодействие с простыми веществами
К ним относятся: кислород, азот, сера, фосфор, галогены (йод, фтор, хлор, бром). По порядку рассмотрим взаимодействие калия с каждым из них. Взаимодействие с кислородом называется окислением. В течение данной химической реакции расходуется калий и оксиген в молярном соотношении четыре части к одной, в результате чего образуется оксид рассматриваемого металла в количестве двух частей. Данное взаимодействие можно выразить при помощи следующего уравнения реакции: 4К + О2 = 2К2О. При горении калия можно наблюдать ярко-фиолетовое пламя.  Поэтому данная реакция считается качественной на определение калия. Реакции с галогенами называются в соответствии с названиями этих химических элементов: это йодирование, фторирование, хлорирование, бромирование. Данные взаимодействия можно назвать реакциями присоединения, так как атомы двух разных веществ объединяются в одно. Примером подобного процесса может служить реакция между калием и хлором, в результате которой образуется хлорид рассматриваемого металла. Для проведения данного взаимодействия необходимо взять два этих компонента - два моля первого и один второго. В результате образуется два моля соединения калия. Эта реакция выражается таким уравнением: 2К + СІ2 = 2КСІ. С азотом калий может давать соединения при горении на открытом воздухе. Во время этой реакции расходуется рассматриваемый металл и азот в молярном соотношении шесть частей к одной, в результате данного взаимодействия образуется нитрид калия в количестве двух частей. Это можно показать в виде следующего уравнения: 6К + N2 = 2K3N. Это соединение представляет собой кристаллы зелено-черного цвета. С фосфором рассматриваемый металл реагирует по такому же принципу. Если взять три моля калия и один моль фосфора, получим один моль фосфида. Данное химическое взаимодействие можно записать в виде такого уравнения реакции: 3К + Р = К3Р. Кроме того, калий способен реагировать с водородом, образуя при этом гидрид. В качестве примера может быть приведено такое уравнение: 2К + Н2 = 2КН. Все реакции присоединения происходят только при наличии высоких температур.
Поэтому данная реакция считается качественной на определение калия. Реакции с галогенами называются в соответствии с названиями этих химических элементов: это йодирование, фторирование, хлорирование, бромирование. Данные взаимодействия можно назвать реакциями присоединения, так как атомы двух разных веществ объединяются в одно. Примером подобного процесса может служить реакция между калием и хлором, в результате которой образуется хлорид рассматриваемого металла. Для проведения данного взаимодействия необходимо взять два этих компонента - два моля первого и один второго. В результате образуется два моля соединения калия. Эта реакция выражается таким уравнением: 2К + СІ2 = 2КСІ. С азотом калий может давать соединения при горении на открытом воздухе. Во время этой реакции расходуется рассматриваемый металл и азот в молярном соотношении шесть частей к одной, в результате данного взаимодействия образуется нитрид калия в количестве двух частей. Это можно показать в виде следующего уравнения: 6К + N2 = 2K3N. Это соединение представляет собой кристаллы зелено-черного цвета. С фосфором рассматриваемый металл реагирует по такому же принципу. Если взять три моля калия и один моль фосфора, получим один моль фосфида. Данное химическое взаимодействие можно записать в виде такого уравнения реакции: 3К + Р = К3Р. Кроме того, калий способен реагировать с водородом, образуя при этом гидрид. В качестве примера может быть приведено такое уравнение: 2К + Н2 = 2КН. Все реакции присоединения происходят только при наличии высоких температур.
Взаимодействие со сложными веществами
Характеристика калия с точки зрения химии предусматривает рассмотрение и этой темы. К сложным веществам, с которыми способен реагировать калий, относятся вода, кислоты, соли, оксиды. Со всеми ними рассматриваемый металл реагирует по-разному.

Калий и вода
Данный химический элемент бурно реагирует с ней. При этом образуется гидроксид, а также водород. Если взять по два моля калия и воды, то получим столько же гидроксида калия и один моль водорода. Данное химическое взаимодействие можно выразить с помощью следующего уравнения: 2К + 2Н2О = 2КОН = Н2.
Реакции с кислотами
Так как калий - активный металл, он с легкостью вытесняет атомы гидрогена из их соединений. Примером может быть реакция, которая происходит между рассматриваемым веществом и соляной кислотой. Для ее проведения нужно взять два моля калия, а также кислоту в том же количестве. В результате образуется хлорид калия - два моля и водород - один моль. Этот процесс можно записать таким уравнением: 2К + 2НСІ = 2КСІ + Н2.

Калий и оксиды
С данной группой неорганических веществ рассматриваемый металл реагирует только при значительном нагревании. Если атом металла, входящего в состав оксида, пассивнее того, о котором мы говорим в данной статье, происходит, по сути, реакция обмена. Например, если взять два моля калия и один моль оксида купрума, то в результате их взаимодействия можно получить по одному молю оксида рассматриваемого химического элемента и чистый купрум. Это можно показать в виде такого уравнения: 2К + CuO = К2О + Cu. Вот где проявляются сильные восстановительные свойства калия.
Взаимодействие с основаниями
Калий способен реагировать с гидроксидами металлов, которые находятся правее него в электрохимическом ряду активности. В таком случае также проявляются его восстановительные свойства. Например, если взять два моля калия и один моль гидроксида бария, то в результате реакции замещения мы получим такие вещества, как гидроксид калия в количестве два моля и чистый барий (один моль) - он выпадет в осадок. Представленное химическое взаимодействие можно отобразить в виде следующего уравнения: 2К + Ba(OH)2 = 2КОН + Ba.
Реакции с солями
В данном случае калий все так же проявляет свои свойства как сильный восстановитель. Замещая атомы химически более пассивных элементов, он позволяет получить чистый металл. Например, если добавить к хлориду алюминия в количестве два моля три моля калия, то в результате данной реакции получим три моля хлорида калия и два моля алюминия. Выразить данный процесс с помощью уравнения можно следующим образом: 3К + 2АІСІ3 = 3КСІ2 + 2АІ.

Реакции с жирами
Если добавить калий к какому-либо органическому веществу данной группы, он также вытеснит один из атомов гидрогена. Например, при смешивании стеарина с рассматриваемым металлом образуется стеарат калия и водород. Полученное вещество применяется для изготовления жидкого мыла. На этом характеристика калия и его взаимодействий с другими веществами заканчивается.
Использование калия и его соединений
Как и все металлы, рассматриваемый в данной статье необходим для многих процессов в промышленности. Основное применение калия происходит в химической отрасли. Благодаря своей высокой химической активности, ярко выраженным щелочнометаллическим и восстановительным свойствам, он применяется в качестве реагента для многих взаимодействий и получения разнообразных веществ. Кроме того, сплавы с содержанием калия используются как теплоносители в ядерных реакторах. Также рассматриваемый в данной статье металл находит свое применение в электротехнике. Помимо всего вышеперечисленного, он является одним из главных компонентов удобрений для растений. Кроме того, его соединения применяются в самых разнообразных отраслях промышленности. Так, в добыче золота используется цианид калия, который служит реагентом для выделения ценных металлов из руд. В производстве стекла применяется карбонат калия. Фосфаты рассматриваемого химического элемента являются компонентами всевозможных чистящих средств и порошков. В спичках присутствует хлорат данного металла. В изготовлении пленок для старых фотоаппаратов использовался бромид рассматриваемого элемента. Как вы уже знаете, добыть его возможно путем бромирования калия в условии высокой температуры. В медицине используется хлорид данного химического элемента. В мыловарении - стеарат и другие производные от жиров.
Получение рассматриваемого металла

В наше время калий добывают в лабораториях двумя основными способами. Первый - восстановление его из гидроксида с помощью натрия, который химически еще более активен, чем калий. А второй - получение его из хлорида, тоже с помощью натрия. Если добавить к одному молю гидроксида калия столько же натрия, образуется по одному молю щелочи натрия и чистого калия. Уравнение данной реакции выглядит следующим образом: КОН + Na = NaOH + К. Для проведения реакции второго типа нужно смешать хлорид рассматриваемого металла и натрий в равных молярных пропорциях. В результате этого образуются такие вещества, как кухонная соль и калий в одинаковом соотношении. Выразить данное химическое взаимодействие можно с помощью такого уравнения реакции: КСІ + Na = NaCl + К.
Строение калия
Атом данного химического элемента, как и всех остальных, состоит из ядра, в котором содержатся протоны и нейтроны, а также электронов, которые вращаются вокруг него. Количество электронов всегда равно количеству протонов, которые находятся внутри ядра. Если же какой-либо электрон отсоединился или присоединился к атому, то он уже перестает быть нейтральным и превращается в ион. Они бывают двух видов: катионы и анионы. Первые обладают положительным зарядом, а вторые - отрицательным. Если к атому присоединился электрон, то он превращается в анион, если же какой-либо из электронов покинул свою орбиту, нейтральный атом становится катионом. Так как порядковый номер калия, согласно таблице Менделеева, девятнадцать, то и протонов в ядре данного химического элемента находится столько же. Поэтому можно сделать вывод, что и электронов вокруг ядра расположено девятнадцать. Количество протонов, которые содержатся в структуре атома, можно определить, отняв от атомной массы порядковый номер химического элемента. Так можно сделать вывод, что в ядре калия находится двадцать протонов. Так как рассматриваемый в этой статье металл принадлежит к четвертому периоду, он имеет четыре орбиты, на которых равномерно располагаются электроны, которые все время находятся в движении. Схема калия выглядит следующим образом: на первой орбите расположены два электрона, на второй - восемь; также как и на третьей, на последней, четвертой, орбите вращается всего один электрон. Этим и объясняется высокий уровень химической активности данного металла - его последняя орбита не заполнена полностью, поэтому он стремится соединиться с какими-либо другими атомами, в результате чего их электроны последних орбит станут общими.
Где можно встретить данный элемент в природе?
Так как он обладает чрезвычайно высокой химической активностью, то на планете он нигде не встречается в чистом виде. Его можно увидеть только в составе разнообразных соединений. Массовая доля калия в земной коре составляет 2,4 процента. Самые распространенные минералы, в состав которых входит калий, - это сальвинит и карналлит. Первый обладает следующей химической формулой: NaCl•KCl. Он обладает пестрой расцветкой и состоит из множества кристаллов разнообразной окраски. В зависимости от соотношения хлорида калия и натрия, а также от наличия примесей, он может содержать красные, синие, розовые, оранжевые составляющие. Второй минерал - карналлит - выглядит как прозрачные, нежно-голубые, светло-розовые либо бледно-желтые кристаллы. Его химическая формула выглядит так: KCl•MgCl2•6Н2О. Он является кристаллогидратом.
Роль калия в организме, симптомы недостатка и избытка
Он вместе с натрием поддерживает водно-солевой баланс клетки. Также он участвует в передаче между мембранами нервного импульса. Кроме того, он регулирует кислотно-щелочной баланс в клетке и во всем организме в целом. Он принимает участие в процессах обмена веществ, противодействует возникновению отеков, входит в состав цитоплазмы - около пятидесяти ее процентов - соли рассматриваемого металла. Главными признаками того, что организму не хватает калия, является отечность, возникновение такого заболевания, как водянка, раздражительность и нарушения в работе нервной системы, заторможенность реакции и ухудшение памяти.  Кроме того, недостаточное количество данного микроэлемента отрицательно сказывается на сердечно-сосудистой и мышечной системах. Недостаток калия на протяжении очень длительного времени может спровоцировать инфаркт либо инсульт. А вот из-за избытка калия в организме может развиться язва тонкого кишечника. Для сбалансирования своего питания таким образом, чтобы получать нормальное количество калия, нужно знать, в каких продуктах он содержится.
Кроме того, недостаточное количество данного микроэлемента отрицательно сказывается на сердечно-сосудистой и мышечной системах. Недостаток калия на протяжении очень длительного времени может спровоцировать инфаркт либо инсульт. А вот из-за избытка калия в организме может развиться язва тонкого кишечника. Для сбалансирования своего питания таким образом, чтобы получать нормальное количество калия, нужно знать, в каких продуктах он содержится.
Еда с высоким содержанием рассматриваемого микроэлемента
Прежде всего, это орехи, такие как кешью, грецкие, фундук, арахис, миндаль. Также большое его количество находится в картошке. Кроме того, калий содержится в сухофруктах, таких как изюм, курага, чернослив. Данным элементом богаты и кедровые орешки. Также высокая его концентрация наблюдается в бобовых: фасоли, горохе, чечевице. Морская капуста также богата данным химическим элементом. Еще одними продуктами, содержащими данный элемент в большом количестве, являются зеленый чай и какао. Кроме того, в высокой концентрации он находится и во многих фруктах, таких как авокадо, бананы, персики, апельсины, грейпфруты, яблоки. Многие крупы богаты рассматриваемым микроэлементом. Это прежде всего перловка, а также пшеничная и гречневая крупа. В петрушке и брюссельской капусте тоже есть много калия. Кроме того, он содержится в моркови и дыне. Лук и чеснок обладают немалым количеством рассматриваемого химического элемента. Куриные яйца, молоко и сыр также отличаются высоким содержанием в них калия. Суточная норма данного химического элемента для среднестатистического человека составляет от трех до пяти граммов.
Заключение
Прочитав эту статью, можно сделать вывод, что калий является чрезвычайно важным химическим элементом. Он необходим для синтезирования многих соединений в химической промышленности. Кроме того, используется и во многих других отраслях. Также он очень важен для организма человека, поэтому должен регулярно и в необходимом количестве поступать туда с едой.
fb.ru
Хромат калия. Получение, химические и физические свойства. Применение
Хромат калия или хромоволокнистый калий (международные названия: Kalium chromicum, Kaliumchromat, Potassium chromate) - это неорганическое соединение, кристаллы желтого цвета ромбической системы, растворимые в воде. Относится к солям хромовой кислоты h3CrO4, которая в свободном состоянии не существует. У вещества хромат калия формула следующая: CrK2O4
Как получают хромат калия?
Хромоволокнистый калий получают несколькими способами:
1. Путем окисления оксида хрома калия хлоратом (реакция происходит при температуре 500-700 градусов):
Cr2O3 (оксид хрома)+ KClO3 (хлорат калия) + K2CO3 (карбонат калия) = 2K2CrO4 (калия хромат) + KCl (хлористый калий) + 2CO2 (углекислый газ)
2. Путем растворения оксида хрома в гидроксиде калия:
CrO3 (хрома оксид) + 2KOH (гидроксид калия) = K2CrO4 (калия хромат) + h3O (вода)
3. Путем разложения дихромата калия при его нагревании (реакция осуществляется при температуре 500-600 градусов):
4K2Cr2O7 (калия бихромат) = 4K2CrO4 (калия хромат) + 2Cr2O3 (оксид хрома) + 3O2 (кислород)
4. Путем воздействия концентрированного раствора калия гидроксида на калия бихромат:
K2Cr2O7 (калия дихромат) + 2KOH (гидроксид калия) = 2K2CrO4 (калия хромат) + h3O (вода)
5. В природе редко встречается минерал, который называется "тарапакаит". Это хромоволокнистый калий с примесями.
Химические свойства хромата калия:
1. В разбавленных кислотах хромоволокнистый калий переходит в дихромат калия, формула которого K2Cr2O7. Примером может служить следующая реакция:
2K2CrO4 (хромат калия) + 2HCl (соляная кислота в разбавленном виде) = K2Cr2O7 (дихромат калия) + 2KCl (хлористый калий) + h3O (вода)
2. При взаимодействии с концентрированными кислотами происходит уже другая реакция, например:
K2CrO4 (хромат калия) + 2HCl (соляная кислота в концентрированном виде) = K(Cr(Cl)O3) (комплексное соединение хрома) + KCl (хлористый калий) + h3O (вода)
3. При взаимодействии с горячими концентрированными кислотами калия хромат проявляет окислительные свойства. Примером может служить следующая реакция, осуществляемая при температуре 90 градусов:
2K2CrO4 (калия хромат) + 16HCl (соляная кислота) = 2CrCl3 (хлорид хрома) + 3Cl2 (хлор в виде газа) + 4KCl (хлористый калий) + 8h3O (вода)
4. Хромоволокнистый калий может вступать в обменные реакции. Например:
K2CrO4 (калия хромат) + 2AgNO3 (нитрат серебра) = Ag2CrO4 (хромат серебра, выпадает в осадок) + 2KNO3 (нитрат калия)K2CrO4 (калия хромат)+ Hg2(NO3)2 (нитрат ртути) = Hg2CrO4 (хромат ртути, выпадает в осадок) + 2KNO3 (нитрат калия)
Физические свойства хромата калия:
1. Плотность составляет 2,732 г/см3.2. Хромат калия плавится при температуре 968,3°С. При температуре 668 градусов переходит в красную гексагональную фазу - приобретает другую окраску - красную. Однако при охлаждении опять становится желтым.3. Образует кристаллы желтого цвета ромбической системы.4. Принадлежит к пространственной группе Р-nam. 5. Относится к парамагнетикам.6. Плохо растворяется в этаноле, растворим в воде. Нерастворим в этиловом и диэтиловом спирте.7. Молярная масса составляет 194,19 г/моль.
Оптические свойства хромата калия:
Показатель преломления составляет 1,74
Где применяется калий хромат?
1. В кожевенной промышленности применяется в качестве дубителя. При крашении тканей используется как протрава.2. Используется как один из компонентов состава электролитов специального химического обезжиривания.3. В качестве отбеливателя для воска и масла.4. В органическом синтезе как окислитель, например, при производстве красителей.5. Также хромоволокнистый калий используется для приготовления раствором оксидирования серебра электрохимического и для пассирования изделий из сплавов меди и серебра.6. В медицине применяется как гомеопатическое средство.7. В лабораториях для мытья посуды используется смесь равных объемов концентрированной кислоты серной и раствора K2Cr2O7, насыщенного предварительно на холоде.
Калий дихромат (техническое название - хромпик)
Представляет собой кристаллы красно-оранжевого цвета. Не образует кристаллогидратов, обладает плотностью 2,684 грамм на кубический сантиметр, плавится при температуре 397 градусов. При дальнейшем нагревании разлагается. Растворимость в воде при 20 градусах равна 12,48 грамм соли на 100 грамм воды. Дихромат калия получил широкое применение как окислитель в пиротехнике, спичечной промышленности и в хромаметрии как реагент.
fb.ru
Калийная соль - кислота - Большая Энциклопедия Нефти и Газа, статья, страница 1
Калийная соль - кислота
Cтраница 1
Калийная соль борогликолевой кислоты I / В ] К ( VI) выкристаллизовывается при сгущении водного раствора 1 моля борной кислоты, 2 молей гликолевой кислоты и 0 5 моля поташа. [1]
Омыление спиртовым раствором едкого кали; образуется свободный спирт и калийная соль кислоты. [2]
Омыление спиртовым раствором едкого кали; образуется свободный спирт и калийная соль кислоты. [3]
При восстановлении нитрозосульфоновых кислот предпочитают употреблять калийные соли, потому что калийные соли азосульфоновой кислоты растворимы труднее, чем натриевые. [4]
Если после охлаждения раствор становится молочным, добавляют еще небольшое количество спиртового раствора едкого кали и продолжают кипячение. Калийную соль кислоты, выкристаллизовавшуюся при охлаждении, промывают холодным спиртом, растворяют в небольшом количестве воды и к отфильтрованному раствс ру прибавляют по 4 75 г h3S04 в виде разбавленной серной кислоты на каждые 50 г введенной дибромянтарной кислоты. При этом выкристаллизовывается кислая калиевая соль ацетилендикарбо-новой кислоты. [5]
Количественное определение кислоты в полиэфире производят после омыления полиэфира различными способами. Простейшим является омыление полиэфира спиртовым раствором щелочи с последующим выделением калийных солей кислоты. Используют также омыление полиэфира моноэтаноламином. [6]
Водная жидкость, из которой осаждено это масло, содержит калийную соль кислоты, кристаллизующейся при осаждении из горячего раствора азотной кислотой и обладающей всеми свойствами бензойной кислоты; для идентификации ее я определил содержание серебра в ее серебряной соли. [7]
Количественное определение кислоты в полиэфире производят после омыления полиэфира различными способами. Простейшим является омыление полиэфира спиртовым раствором щелочи, с последующим выделением калийных солей кислоты. Используют также омыление полиэфира моноэтаноламином. [8]
В последнем номере настоящего журнала Бейер и Виллигер 3 напечатали сообщение об озоновой кислоте, которое находится в тесной связи с указанными выше исследованиями. При пропускании кислорода, содержащего озон, над твердой гидроокисью калия они получили оранжево-коричневое вещество, которое они называют калийной солью озоновой кислоты и считают тождественным с четырехокисыо калия. Повидимому, то же самое соединение получается, если пропускать кислород, содержащий озон, через едкое кали при охлаждении. [9]
Следует еще добавить, что в 1943 г. были получены данные Фернелиуса, Марки и Рей-нольдса [2], которые сделали попытку расщепить калийную соль ура-нощавелевой кислоты на оптические антиподы. Надо, однако, отметить, что величины наблюдаемых вращений были очень невелики по сравнению с ошибкой измерений. [10]
Дибромннтнрную кислоту растворяют в возможно меньшем количество горячего спирта, дают раствору охладиться, добавляют небольшими порциями 4 моля спиртового раствора одного кали ] i нагревают до кипении в точение 1 часа на водяной бапо. Калийную соль кислоты, иыкристаллизовав-шуюся ври охлаждении, проминают холодным спиртом, растворяют в небольшом количестве воды и к отфильтрованному раствору прибавляют по 4 75 г Н2 О4 и иидо разбавленной серной кислоты: на каждые оО г введенной дибромяитарной кислоты. [11]
Органические кислоты имеют важное значение в метаболизме углерода, энергетическом обмене микроорганизмов, синтетических и диссимиляционных процессах. Использование кислот жирного ряда в качестве источника углерода зависит от вида и расы дрожжей, концентрации кислоты, длины ее углеродной цепи и степени электролитической диссоциации. Хорошими субстратами служат кислоты с длиной углеродной цепи от С2 до С4 ( уксусная, пировиноград-ная, молочная, масляная и др.) при сравнительно низкой концентрации. Калийные соли кислот, содержащих в молекуле от 2 до 5 атомов углерода, стимулируют рост дрожжей в 1 4 - 3 3 раза по сравнению с соответствующими кислотами. [12]
В керамиковую банку емкостью 2 л, снабженную механической мешалкой и термометром, загружают 860 мл воды, 43 А сернокислого магния и 43 г уксуснокислого натрия и нагревают на водяной бане. Прибавление марганцовокислого калия регулируют таким образом, чтобы в растворе не было большого избытка последнего: фильтровальная бумага, смоченная несколькими каплями раствора, должна окрашиваться в бледнолилавый цвет. Реакция продолжается около 6 час. После введения всего количества марганцевокислого калия перемешивание продолжают еще некоторое время до полного обесцвечивания раствора. Горячий раствор отфильтровывают на бюхнеровской воронке от образовавшейся перекиси марганца; последнюю промывают несколько раз горячей водой до полного отделения калийной соли р-ацето-аминобензойной кислоты. [13]
Страницы: 1
www.ngpedia.ru
Ацетат калия - раствор, получение, применение
Ацетат калия представляет собой одну из солей уксусной кислоты.
Получение ацетата калия и его свойства
Ацетат калия имеет вид белых или бесцветных кристаллов, имеющих слабощелочной вкус. Кристаллы очень гигроскопичны и на открытом воздухе под действием водяных паров они достаточно быстро расплываются. В эфире кристаллы практически не растворяются, но хорошо растворимы в воде с образованием раствора ацетата калия.
По своей токсичности ацетат калия соответствует уксусной кислоте. Обладает выраженными консервирующими свойствами, благодаря которым предотвращает развитие патогенных грибков и бактерий.
Ацетат калия, как уже говорилось, является солью уксусной кислоты. Поэтому его получают в результате взаимодействия гидроксида или карбоната калия с раствором уксусной кислоты. Реакцию получения ацетата калия можно записать так:
К2СО3 + 2СН3СООН = 2 СН3СООК + Н2СО3
Угольная кислота, получаемая в результате этой реакции, является нестойким веществом, практически мгновенно разлагающимся на углекислый газ и воду. Поэтому конечным продуктом реакции является водный раствор ацетата калия, выпарив который можно получить чистое вещество в виде кристаллов.
Применение ацетата калия
В пищевой промышленности кристаллы и раствор калия ацетата используются как консерванты и регуляторы кислотности. При длительном хранении кислотность любого продукта начинает изменяться. Для предотвращения этого и используется ацетат калия, который называют пищевой добавкой Е-261. Синонимами ацетата калия являются следующие названия: уксуснокислый калий, диацетат калия и другие.
Чаще всего ацетат калия используется в процессе приготовления различных фруктовых и томатных соусов, в сыроварении и хлебопечение. Также эта пищевая добавка широко применяется при мариновании томатов и огурцов. Благодаря ее использованию смягчается резкий кислый вкус готового продукта, обусловленный использованием уксусной кислоты.
Ацетат калия используется и в фармакологии. Он входит в состав некоторых мочегонных лекарственных средств. Помимо этого благодаря своей способности разлагаться на бикарбонаты и за счет этого снижать общий уровень кислотности, раствор калия ацетата применяется в комплексной терапии диабетического кетоацидоза.
Также ацетат калия широко используется в текстильной промышленности и при производстве кормов для сельскохозяйственных животных.
Влияние ацетата калия на организм человека
Ацетат калия разрешено использовать в качестве пищевой добавки без каких-либо ограничений только на Украине и в России. Во всех остальных странах Европы и в США это вещество считается далеко не безопасным и поэтому применение его резко ограничено.
Не желательно употреблять в пищу продукты, содержащие ацетат калия людям, страдающим заболеваниями желчного пузыря, почек и мочевыводящих путей и сердечно-сосудистой системы.
С большой осторожностью подобные продукты могут употреблять люди с заболеваниями желудочно-кишечного тракта, а также те, кто страдает различными аллергическими заболеваниями и/или не переносит уксусную кислоту.
При производстве продуктов, предназначенных для детского питания, использование ацетата калия категорически запрещено, впрочем, как и уксусной кислоты. Поэтому если вы увидите на упаковке с детским пюре или соком, что в их состав входит пищевая добавка Е-261, то от покупки такой продукции следует отказаться.
Безопасная суточная норма употребления ацетата калия не установлена, поэтому в России нет ограничений на его использование.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Знаете ли вы, что:
Согласно мнению многих ученых, витаминные комплексы практически бесполезны для человека.
По статистике, по понедельникам риск получения травм спины увеличивается на 25%, а риск сердечного приступа – на 33%. Будьте осторожны.
На лекарства от аллергии только в США тратится более 500 млн долларов в год. Вы все еще верите в то, что способ окончательно победить аллергию будет найден?
Наши почки способны очистить за одну минуту три литра крови.
Для того чтобы сказать даже самые короткие и простые слова, мы задействуем 72 мышцы.
Средняя продолжительность жизни левшей меньше, чем правшей.
Общеизвестный препарат «Виагра» изначально разрабатывался для лечения артериальной гипертонии.
Работа, которая человеку не по душе, гораздо вреднее для его психики, чем отсутствие работы вообще.
Даже если сердце человека не бьется, то он все равно может жить в течение долгого промежутка времени, что и продемонстрировал нам норвежский рыбак Ян Ревсдал. Его "мотор" остановился на 4 часа после того как рыбак заблудился и заснул в снегу.
В нашем кишечнике рождаются, живут и умирают миллионы бактерий. Их можно увидеть только при сильном увеличении, но, если бы они собрались вместе, то поместились бы в обычной кофейной чашке.
При регулярном посещении солярия шанс заболеть раком кожи увеличивается на 60%.
Самая высокая температура тела была зафиксирована у Уилли Джонса (США), который поступил в больницу с температурой 46,5°C.
Во время работы наш мозг затрачивает количество энергии, равное лампочке мощностью в 10 Ватт. Так что образ лампочки над головой в момент возникновения интересной мысли не так уж далек от истины.
Кариес – это самое распространенное инфекционное заболевание в мире, соперничать с которым не может даже грипп.
Человек, принимающий антидепрессанты, в большинстве случаев снова будет страдать депрессией. Если же человек справился с подавленностью своими силами, он имеет все шансы навсегда забыть про это состояние.
www.neboleem.net
Карбонат калия, соляная кислота
Карбонат калия (поташ) в обычных условиях представляет собой порошок белого цвета, который плавится без разложения, а при дальнейшем нагревании разлагается. Карбонат калия очень хорошо растворяется в воде (гидролизуется по аниону), создавая сильнощелочную среду. Реагирует с кислотами, неметаллами, оксидами неметаллов. Вступает в реакции обмена.
Взаимодействие между веществами карбонат калия и соляная кислота относится к реакциям обмена, о том, что оно протекает необратимо, т.е. до конца, можно судить по выделению газообразного продукта, которым является диоксид углерода. Уравнение реакции выглядит следующим образом:
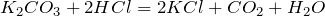 .
.
Переходим к решению задачи. Определим количество вещества карбоната калия, вступившего в реакцию:
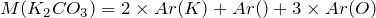 ;
;
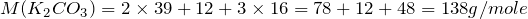 .
.
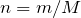 ;
;
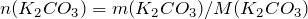 ;
;
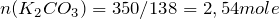 .
.
Mольное соотношение между карбонатом калия и диоксидом углерода имеет вид:
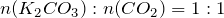 ,
,
т.е. 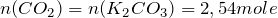 .
.
Тогда, объем диоксида углерода, выделившийся в ходе реакции взаимодействия карбоната калия с соляной кислотой будет равен:
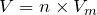 ;
;
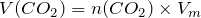 ;
;
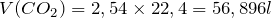 .
.
ru.solverbook.com
Азотная кислота в производстве нитрата калия
Производство нитрата калия нейтрализацией щелочей азотной кислотой или оксидами азота вследствие необходимости затраты дорогого сырья (гидроксида калия или поташа) осуществляется редко. [c.219]
ПРОИЗВОДСТВО НИТРАТА КАЛИЯ ИЗ ХЛОРИДА КАЛИЯ и АЗОТНОЙ КИСЛОТЫ или ОКСИДОВ АЗОТА [c.303]
По проекту ГИАПа на Березниковском АТЗ в 1960 г. был построен и пущен в эксплуатацию крупный опытно-промышленный цех получения нитрата калия методом катионного обмена. Процесс производства нитрата калия катионным методом прост по технологии и аппаратуре, не требует дефицитных щелочей или крепкой азотной кислоты и т. п. [c.50]
Производство нитрата калия из хлористого калия и азотной кислоты или окислов азота [c.322]
Непоглощенные при производстве азотной кислоты хвостовые нитрозные газы улавливаются растворами щелочей (едким кали или поташом). В результате поглощения нитрозных газов растворами поташа или едкого кали образуется смесь нитрита и нитрата. [c.42]
Процесс Поглощения окислов азота кальцинированной содой, (или каустической) и инвертирование нитрита в нитрат протекает аналогично тому, как это описано в главе И при изложении метода получения калиевой селитры из едкого кали (или поташа), хвостовых окислов азота и азотной кислоты. В связи с этим ниже излагается только схема производства натриевой селитры, без объяснения особенностей протекающих процессов. [c.65]
Нитрат кальция применяется как исходный продукт для получения нитрозных газов при производстве камерным методом серной кислоты. Он служит также сырьем для получения обменным разложением нитратов калия, свинца, хрома и других солей азотной кислоты. [c.86]
Концентрация применяемой в реакции азотной кислоты должна быть такова, чтобы образовавшийся нитрат калия оставался растворенным. Нерастворимый материал, включающий сернокислый кальций, образовавшийся при реакции, отфильтровывается и промывается, а фильтрат обрабатывается аммиаком, причем образуется густой шлам, состоящий из трех молей нитрата калия и одного М0.1Я моноаммонийфосфата. Шлам выпаривается досуха и разбрызгивается, как при производстве изоморфной смеси фосфатов аммония и калия. Полученный таким образом сухой продукт содержит приблизительно 15% азота, 16% фосфорной кислоты (Р О ) и 33% калия (КгО). [c.372]
Многие усовершенствованные конструкции экстракторов (центробежные, пульсационные и другие) позволяют осуществить процесс при очень низких факторах разделения. Это дает возможность применить селективную экстракцию в самых разнообразных случаях. Например, для концентрирования [65] теплочувствительных или агрессивных растворов (вместо их выпаривания), в производстве удобрений (в частности, нитрата калия из хлорида калия и азотной кислоты) и для получения фосфорной кислоты из солянокислотной, а также азотнокислотной вытяжки фосфатов [63а, 66—70]. [c.289]
Азотная кислота применяется в производстве нитратов аммония, калия, натрия и кальция. Все эти азотные удобрения выпускаются химической промышленностью в большом количестве. Кроме того, азотная кислота используется при получении фосфорных и азотно-фосфорных удобрений. [c.61]
Азотная кислота — один из важнейших продуктов химической промышленности. По объему производства азотная кислота находится на втором месте после серной кислоты. Азотная кислота является сырьем для выработки многих продуктов, применяемых в промышленности и сельском хозяйстве. В нашей стране около 40% вырабатываемой азотной кислоты расходуется на производство сложных и азотных минеральных удобрений, нитратных солей (нитратов натрия, калия и кальция). Концентрированная азотная кислота применяется в производстве соединений ароматического ряда для синтеза красителей в производстве взрывчатых веществ (нитроглицерина, продуктов нитрования толуола), уротропина, ди-метиланилина, ксилола в фармацевтической промышленности для получения нафталина, нитропроизводных бензола, химикатов для фотографии. [c.5]
Выход нитрата калия по азотной кислоте при использовании части маточного раствора составляет 70%. На производство [c.324]
В СССР в начале 50-х годов было разработано и внедрено в производство ионообменное получение калиевой селитры на катионите КУ-1. Исходными веществами были технический хлорид калия и раствор нитрата кальция, приготовленный из отходов известняка (щебенки) и слабой азотной кислоты [c.185]
В качестве исходного сырья в этом процессе используются упаренные растворы нитрата натрия, образующиеся при щелочной абсорбции отходящих нитрозных газов производства разбавленной азотной кислоты (стр. 45 сл.), и стандартный хлористый калий первого или второго сорта (стр. 227). [c.254]
СИД железа, содержащий в качестве промоторов оксид алюминия, кальций, калий и, вероятно, немного оксида кремния. В патентной литературе в качестве промотора предлагается также оксид церия. Если это окажется усовершенствованием катализатора, то оно будет единственным за последние 75 лет. Но это не тот рекорд, которым могут гордиться каталитики. В настоящее время процесс ведут иод давлением лишь 2000 фунт/дюйм , тогда как на первых заводах во время второй мировой войны оно составляло 5000 и даже 12 000 фунт/дюйм . Аммиак является одним из основных продуктов химической промышленности его мировое производство составляет 70 млн. т в год. Большая часть аммиака идет на производство удобрений, значительную часть его перерабатывают в азотную кислоту и нитраты. Реактор синтеза аммиака очень похож на реактор синтеза спиртов (рис. 1—3). Более подробную информацию об этом можно найти в гл. 4 т. 3. [c.124]
Азотная кислота находит очень широкое применение п народном хозяйстве. В огромных количествах она используется в производстве азотных удобрений, органических красителей и т. д. Большое значение имеют также соли азотной кислоты. Например, нитраты натрия, калия, аммония, кальция в больших количествах используются как удобрения (о получении KNO3 из NiiNOa см. 3, гл. VII). [c.304]
Нитрат натрия НаМОз образует бесцветные кристаллы, очень напоминающие кристаллы кальцита СаСОз. Такое сходство не случайно. Кристаллы имеют одну и ту же структуру, причем ионы На+ занимают место ионов Са2+, а ионы ЫОз занимают место ионов СОз . Кристаллы нитрата натрия обладают тем же свойством двойного лучепреломления, что и кристаллы кальцита. Нитрат натрия применяют в качестве удобрения, а также при производстве азотной кислоты и других нитратов. Нитрат калия КМОз (селитра) используют при консервировании мяса (ветчины, колбас), в медицине и при производстве черного пороха, представляющего собой тонкую смесь нитрата калия, древесного угля и серы, взрывающуюся при поджигании в замкнутом пространстве. [c.231]
Выход нитрата калия по азотной кислоте при использовании части маточного раствора составляет 70%. На производство 1 т продукта расходуется только 4 т пара вместо И т по методу конверсии КС1 и NaN03. [c.440]
Получение нитратов калия и натрия взаимодействием хлоридов с NOj или с азотной кислотой является одним из экономичных путей производства этих продуктов при условии использования хлора, выделяющегося в газовую фазу в виде СЬ, НС1 и NO I. Особенно важно использование хлористого нитрозила, так как в противном случае потеря содержащегося в нем азота делает производство нерентабельным Хлористый нитрозил может быть окислен до NO2 и I2 кислородом воздуха в присутствии концентрированной азотной кислоты или в присутствии катализаторов МпОг, РегОз и др. Хлористый нитрозил может быть использован также для хлорирования окислов и других веществ освобождающаяся при этом N0 может быть переработана в азотную кислоту. Существуют и другие методы переработки хлористого нитрозила, В последнее время интерес к этому способу привлекает внимание еще и потому, что хлористый нитрозил, ранее не находивший применения, может быть использован для получения полупродуктов, применяемых в производстве полиамидных смол. [c.441]
Хлористый водород является побочным продуктом и в ряде процессов неорганической технологии, например, при гидролизе хлористого магния с целью получения окиси магния (стр. 299), при некоторых способах конверсии хлоридов в нитраты азотной кислотой, при переработке хлористого калия и полиминеральных калийных руд (см. гл. V) на бесхлорные удобрения, и пр. На некоторых заводах в США при производстве металлического магния из хлористого магния в электролизеры загружают не полностью обезвоженный хлористый магний (приблизительно. Mg b 1,25НгО). На этих заводах 40% хлора выделяется в виде хлористого водорода, улавливаемого водой.с образованием слабой соляной кислоты . [c.388]
Наиболее широко применяемые соли азотной кислоты являются стойкими соединениями (нитраты калия, натрия и др.) и при выделении их из водных растворов выпариванием они не разлагаются. Значительная же часть нитратов, образованных азотной кислотой (одной из сильных кислот) и различными сравнительно слабыми основаниями, подвергается в воде гидрог литическому расщеплению. В связи с этим для предотвращения гидролиза нитратов, почти как правило, приходится в производстве прибавлять к раствору небольшой избыток азотт ной кислоты (при получении нитратов свинца, алюминия, мута, ртути, марганца и др.). [c.7]
НИТРОФОСКА. Сложное удобрение, содержащее азот, фосфор и калий. Общее содержание питательных веществ, в зависимости от метода производства, колеблется от 35 до 52%, а в Н., получаемых на основе фосфатов аммония, может достигать 60%. Все виды Н. выпускаются в гранулированном виде, обладают удовлетворительными физическими свойствами, малогигроскопичны, не слеживаются и хорошо рассеваются. Наиболее распространенным способом получения Н. в большинстве стран является разложение природных фосфатов азотной кислотой или смесью азотной с серной или фосфорной кислотами, с последующей нейтрализацией аммиаком и добавлением калийных солей. По одному из способов Н. получают, вымораживая из азотнокислотной вытяжки нитрата кальция. Н. М01ЖН0 получить также путем сплавления фосфатов аммония с аммиачной селитрой и калийными солями. Наиболее целесообразно применение Н. в тех случаях, когда необходимо в один прием вносить азот, фосфор и калий. Особенно велика потребность в Н. в нечерноземных районах и во влажных районах лесостепной зоны. [c.201]
Широкое применение в производстве нитрофоски получила кристаллизация соли Са(М0з)2-4Н20 при охлаждении до температуры от —5 до —10 °С реакционной смеси, получаемой путем разложения фосфатного сырья 58—60%-ной азотной кислотой при 40—50 °С [42J. После отделения нитрата кальция и дообработки маточной жидкости (аммонизация, выпаривание, гранулирование в смеси с хлоридом калия и кондиционирование) получают нитро- [c.166]
Разработан новый способ производства концентрированных удобрений вымораживанием нитрата кальция и двухступенчатой дистилляцией раствора фосфорной кислоты. Фосфат разлагается оборотной азотной кислотой в обычных условиях далее производится обесфторивание раствора нитратом натрия или калия при избытке этих осадителей не более 20—30% от стехиометрического количества. Вымораживание нитрата кальция из обесфторенного раствора ведут до соотнощения в нем СаО Рг05= 1 1. Затем раствор поступает в первую ступень дистилляции, проводимую при 105—110°С и атмосферном давлении при этом отгоняется разбавленная азотная кислота, используемая для абсорбции окислов азота. Вторая ступень дистилляции проводится распылительной сушилке, где из раствора выделяется монокальцийфосфат и отгоняется 45—50%-ная азотная кислота, возвращаемая на разложение фосфатного сырья. [c.269]
Разложение ф о с ф эта азотной кислотой с получением кальциевой селитры. Фосфат разлагается азотной кислотой, иногда с небольшой добавкой нитрата аммония. При охлаждении полученного раствора выделяется избыток СаО (из расчета на дикальцийфосфат) в форме четырехводного нитрата кальция a(N0j)2-41 20 или двойной соли 5Са(ЫОз).,-Nh5NO,.-lOH.jO. Маточный раствор после отделения кристаллического осадка нейтрализуют аммиаком. В результате дальнейшей переработки раствора получается двойное сложное удобрение, содержащее около 20% каждого питательного вещества (в пересчете на PjO.-, и N). При добавлении в процессе производства хлористого калия или сульфата калия в получаемый продукт вводится третий питательный компонент—калий и получается тройное удобрение типа нитрофоски с содержанием 11,5— 15,7% каждого питательного вещества (в пересчете на Р2О5, N и К2О). [c.164]
Токсикологический и судебнохимический интерес представляют как азотная кислота, так и соли ее — нитраты натрия и калия. В организме нитраты превращаются в еще болез ядовитые нитриты. Отравления нитратами могут иметь место в результате смешения их с другилш солями. При широком распространении нитратов в природе и пище (нитрат калия применяется при засолке мяса) нахождение их может иметь значение лишь при больших количествах обнаруженных нитратов. Азотная кислота (точнее, ее окислы) может быть причиной и производственных отравлений при ее производстве и применении. Предельно допустимой концентрацией окислов азота в воздухе является 0,005 мг/л при пересчете на NgO . [c.362]
Аммиак и азотная кислота используются для производства нитратов аммония, натрия, калия и кальция, сульфата аммония, мочевины, аммофоса и других удобрений. К простым азотным удобрениям относятся аммиачная селитра, натриевая и кальциевая селитры, сульфат а.ммония и мочевина К сложным удобрениям, содержащим азот, относятся калийная [c.187]
chem21.info




 Плотность калия составляет восемьдесят шесть сотых грамма на сантиметр кубический. Это очень легкий металл. Формула калия очень проста - он не формирует молекул. Данное вещество состоит из атомов, которые расположены близко друг к другу и имеют кристаллическую решетку. Атомная масса калия равняется тридцати девяти граммам на моль. Твердость его очень низкая - его можно легко порезать ножом, как сыр.
Плотность калия составляет восемьдесят шесть сотых грамма на сантиметр кубический. Это очень легкий металл. Формула калия очень проста - он не формирует молекул. Данное вещество состоит из атомов, которые расположены близко друг к другу и имеют кристаллическую решетку. Атомная масса калия равняется тридцати девяти граммам на моль. Твердость его очень низкая - его можно легко порезать ножом, как сыр. Поэтому данная реакция считается качественной на определение калия. Реакции с галогенами называются в соответствии с названиями этих химических элементов: это йодирование, фторирование, хлорирование, бромирование. Данные взаимодействия можно назвать реакциями присоединения, так как атомы двух разных веществ объединяются в одно. Примером подобного процесса может служить реакция между калием и хлором, в результате которой образуется хлорид рассматриваемого металла. Для проведения данного взаимодействия необходимо взять два этих компонента - два моля первого и один второго. В результате образуется два моля соединения калия. Эта реакция выражается таким уравнением: 2К + СІ2 = 2КСІ. С азотом калий может давать соединения при горении на открытом воздухе. Во время этой реакции расходуется рассматриваемый металл и азот в молярном соотношении шесть частей к одной, в результате данного взаимодействия образуется нитрид калия в количестве двух частей. Это можно показать в виде следующего уравнения: 6К + N2 = 2K3N. Это соединение представляет собой кристаллы зелено-черного цвета. С фосфором рассматриваемый металл реагирует по такому же принципу. Если взять три моля калия и один моль фосфора, получим один моль фосфида. Данное химическое взаимодействие можно записать в виде такого уравнения реакции: 3К + Р = К3Р. Кроме того, калий способен реагировать с водородом, образуя при этом гидрид. В качестве примера может быть приведено такое уравнение: 2К + Н2 = 2КН. Все реакции присоединения происходят только при наличии высоких температур.
Поэтому данная реакция считается качественной на определение калия. Реакции с галогенами называются в соответствии с названиями этих химических элементов: это йодирование, фторирование, хлорирование, бромирование. Данные взаимодействия можно назвать реакциями присоединения, так как атомы двух разных веществ объединяются в одно. Примером подобного процесса может служить реакция между калием и хлором, в результате которой образуется хлорид рассматриваемого металла. Для проведения данного взаимодействия необходимо взять два этих компонента - два моля первого и один второго. В результате образуется два моля соединения калия. Эта реакция выражается таким уравнением: 2К + СІ2 = 2КСІ. С азотом калий может давать соединения при горении на открытом воздухе. Во время этой реакции расходуется рассматриваемый металл и азот в молярном соотношении шесть частей к одной, в результате данного взаимодействия образуется нитрид калия в количестве двух частей. Это можно показать в виде следующего уравнения: 6К + N2 = 2K3N. Это соединение представляет собой кристаллы зелено-черного цвета. С фосфором рассматриваемый металл реагирует по такому же принципу. Если взять три моля калия и один моль фосфора, получим один моль фосфида. Данное химическое взаимодействие можно записать в виде такого уравнения реакции: 3К + Р = К3Р. Кроме того, калий способен реагировать с водородом, образуя при этом гидрид. В качестве примера может быть приведено такое уравнение: 2К + Н2 = 2КН. Все реакции присоединения происходят только при наличии высоких температур.



 Кроме того, недостаточное количество данного микроэлемента отрицательно сказывается на сердечно-сосудистой и мышечной системах. Недостаток калия на протяжении очень длительного времени может спровоцировать инфаркт либо инсульт. А вот из-за избытка калия в организме может развиться язва тонкого кишечника. Для сбалансирования своего питания таким образом, чтобы получать нормальное количество калия, нужно знать, в каких продуктах он содержится.
Кроме того, недостаточное количество данного микроэлемента отрицательно сказывается на сердечно-сосудистой и мышечной системах. Недостаток калия на протяжении очень длительного времени может спровоцировать инфаркт либо инсульт. А вот из-за избытка калия в организме может развиться язва тонкого кишечника. Для сбалансирования своего питания таким образом, чтобы получать нормальное количество калия, нужно знать, в каких продуктах он содержится.

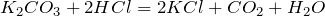 .
.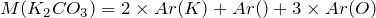 ;
;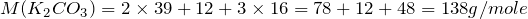 .
.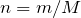 ;
;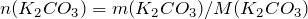 ;
;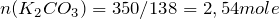 .
.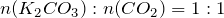 ,
,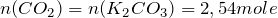 .
.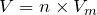 ;
;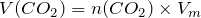 ;
;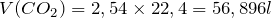 .
.