7. Понятие ДЭС. Модельные представления о строении ДЭС на границе раздела фаз. Дэс строениеСтроение ДЭСКоличество просмотров публикации Строение ДЭС - 606 Электрокинетические явления ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА КОЛЛОИДНЫХ СИСТЕМ К электрокинетическим явлениям относятся электрофорез, электроосмос, потенциал седиментации и потенциал течения. Первые два явления открыты в 1808 ᴦ. Ф. Ф. Рейссом, вторые несколько позже: потенциал седиментации - Дорном в 1878 ᴦ. (иногда его называют эффектом Дорна), потенциал протекания - Квинке в 1859 ᴦ. Электрофорезом принято называть движение частиц дисперсной фазы относительно дисперсионной среды под действием внешнего электрического поля. Электрофорез можно наблюдать в U-образной трубке, заполненной дисперсной системой с жидкой дисперсионной средой. В случае если в U-образной трубке поставить кварцевую диафрагму, то при наличии внешнего электрического поля будет наблюдаться движение дисперсионной среды к отрицательному электроду. Это явление принято называть электроосмосом. Оба явления обусловлены наличием заряда на поверхности раздела частица–жидкость или жидкость – мембрана. Потенциал течения возникает при движении жидкости через пористую диафрагму под влиянием приложенной извне силы и распределяется по длине диафрагмы. Это явление по своей физической сути противоположно электроосмосу. Потенциал седиментации возникает при осаждении частиц в гравитационном поле, распределяется по длине трубки и по своей сути противоположен электрофорезу. По современным представлениям заряд коллоидных частиц лиозолей обусловлен существованием на их поверхности двойного электрического слоя, или сокращенно ДЭС, который возникает за счёт избирательной адсорбции одного из ионов раствора или за счёт ионизации поверхностных молекул вещества. Выглядит это следующим образом. Пусть в растворе KI находятся кристаллы AgI. Иодид-ионы как потенциалопределяющие будут достраивать кристаллическую решетку частиц, заряжая их отрицательно. Противоионы калия находятся в растворе вблизи межфазной границы. Весь комплекс нейтрален, принято называть мицеллой и изображается в виде формулы [nAgImI-(m-x)K+]xK+. Возникновение ДЭС по второму механизму происходит на частицах водного золя диоксида кремния. В этом случае диоксид гидратируется с образованием кремниевой кислоты, которая диссоциирует по схеме : h3SiO3 = SiO32- + 2H+. Ионы водорода переходят в раствор, а поверхность заряжается отрицательно. ДЭС обычно рассматривают как конденсатор, состоящий из двух обкладок, одна из них связана с дисперсной фазой, другая с дисперсионной средой. По теории Гельмгольца ДЭС - ϶ᴛᴏ плоский конденсатор, одна из обкладок которого находится на поверхности твердого тела, другая с противоположным зарядом - в жидкости. Падение потенциала в такой модели линейно. Схема такого слоя представлена на рис. 7.1. Рис. 7.1. Схема ДЭС по Гельмгольцу Поверхностный заряд определяется по формуле , (7.1) где e – абсолютная диэлектрическая проницаемость среды между обкладками, j0 – разность потенциалов между дисперсной фазой и раствором, d – расстояние между обкладками. Позже появилась теория Гуи–Чэпмена, причем каждый из ученых предложил ее независимо от другого. По представлениям этой теории ДЭС состоит из плотной и диффузной частей. Диффузная часть возникает из-за теплового движения ионов, благодаря ее наличию падение потенциала в ДЭС имеет криволинейный характер. На рис. 7.2 представлена схема строения ДЭС по Гуи–Чэпмену. Число противоионов по мере удаления от границы раздела уменьшается в соответствии с законом распределения Больцмана и для точки с потенциалом jч определяется по формулам С+ = С ¥ exp (-Fz jч /RT ), (7.2) C- = C exp ( Fz jч /RT ), где z – валентность иона, С+,С- – концентрация катиона и аниона, соответственно, С¥ – концентрация для точки j¥ = 0. Линия АВ на рис. 7.2 - ϶ᴛᴏ граница скольжения при перемещении жидкой и твердой фаз. В этой точке реализуется потенциал z (дзета-потенциал), или электрокинетический потенциал. Именно данный потенциал определяет перемещение фаз при наложении электрического поля. В случае если ввести в систему индифферентный электролит, то общий скачок потенциала не изменится. При этом при этом будет уменьшаться толщина диффузного слоя, так как для компенсации заряда потенциалопределяющих ионов требуется одно и то же число противоионов. Происходит сжатие ДЭС и меняется распределение в нем потенциала. Изменяется и дзета-потенциал, как это наглядно представлено на рис. 7.3. Рис. 7.2. Строение ДЭС по Гуи-Чэпмену Рис. 7.3. Влияние индифферентного электролита на толщину ДЭС и дзета-потенциал (концентрация электролита растет от 1 к 4) При некоторой концентрации дзета-потенциал исчезает (кривая 4). Теория Гуи–Чэпмена не объясняет целый ряд фактов, таких как влияние многовалентных ионов, ионов разной природы на дзета-потенциал. Она неприемлема для концентрированных коллоидных растворов. В 1924 году была предложена теория Штерна, которая объединила обе рассмотренные выше теории. По Штерну, несколько первых слоев противоионов притягиваются к стенке под влиянием электростатических и адсорбционных сил, так что часть противоионов находится близко у поверхности и образует плоский конденсатор толщиной d. В этом слое, который часто называют слоем Гельмгольца, наблюдается резкое падение потенциала. Остальные противоионы образуют диффузную часть ДЭС, которую называют слоем Гуи. referatwork.ru 7. Понятие ДЭС. Модельные представления о строении ДЭС на границе раздела фаз. Физическая химия: конспект лекций7. Понятие ДЭС. Модельные представления о строении ДЭС на границе раздела фаз ДЭС – двойной электрический слой – тонкий поверхностный слой из пространственно разделенных электрических зарядов противоположного знака, образующихся на границе двух фаз. Если погрузить металлическую пластину (электрод) в раствор соли данного металла, то может произойти один из двух процессов. 1. Пусть металл является активным восстановителем, т. е. окисляется, тогда из-за диполей воды, содержащихся в данном растворе, какая-то часть атомов металла оставляет свои электроны на электроде и из-за процесса гидратации в виде гидратированных ионов переходит в раствор по реакции. Общий вид реакции  или, без учета гидратации ионов,  Этот процесс называется окислением. В результате него металлическая пластинка заряжается отрицательно, а катионы металла притягиваются к ней, и прилегающий к пластинке слой раствора заряжается положительно. На границе металл-раствор возникает ДЭС. Химически активные металлы как: Na, Mg, Al, Zn и др. имеют большие концентрации поверхностного раствора, состоящего из гидратированных катионов металла. При погружении в раствор своей соли любой концентрации происходит дополнительное растворение металла с образованием ДЭС, так как всегда концентрация поверхностного раствора всегда больше концентрации соли металла, и металл заряжается отрицательно. 2. Пусть металл является слабым восстановителем, тогда его ионы, содержащиеся в растворе соли, являются сильными окислителями. Некоторая часть ионов подходит к металлической поверхности и восстанавливается за счет свободных электронов, присутствующих в ней по реакции:  В результате процесса восстановления металлическая пластинка заряжается положительно и притягивает отрицательно заряженные частицы. При погружении малоактивных благородных металлов (Cu, Ag, Au и др.) в раствор соли наблюдается обратная картина, от первой: при любой достижимой концентрации, концентрация поверхностного раствора меньше концентрации соли металла, поэтому ионы металлов осаждаются на электроде, а в приэлектродном пространстве накапливается избыточный отрицательный заряд за счет анионов соли или ионов гидроксидной группы OH–. После достижения равновесной разницы потенциалов между металлом и раствором переход ионов в раствор прекращается. Модельные представления о строении ДЭС на границе раздела фаз: 1) модель Гельмгольца; 2) модель Гуи, Чапмена; 3) модель Штерна; 4) модель Грэма; 5) модель современная. Первая модель ДЭС открыта Гельмгольцем, он представлял ДЭС в виде двух обкладок плоского конденсатора, одна обкладка расположена непосредственно на поверхности электрода, вторая – в электролите. d = диаметру молекул Н2О. Так как все заряды сконцентрированы в двух плоскостях, то изменение потенциала по мере удаления от поверхности электрода Е0 будет описываться прямой линией. Еа– величина электродного удаления от поверхности электрода потенциала. Используя теорию конденсатора, Гельмгольц рассчитал величину заряда ДЭС и величину дифференциальной емкости ДЭС. q – величина заряда = (D/4?2)Е0, С – дифференциальная емкость ДЭС = D/4?2, D – диэлектрическая проницаемость раствора, d – расстояние между обкладками конденсатора. Теория Гельмгольца позволила объяснить ход электрокапиллярной кривой, рассчитать величину дифференциальной емкости ДЭС, хорошо совпадающую с экспериментально полученными данными. Наилучшая сходимость была получена для концентрированных растворов элементов, однако данная теория не объясняла зависимость плотности заряда и дифференциальной емкости ДЭС от состава электролита и концентрации компонента. Недостатки теории Гельмгольца: 1) не учитывалось тепловое движение ионов в растворе; 2) не учитывался размер ионов; 3) не рассматривались процессы адсорбции на границе раздела фаз (электрод – электролит). Ее применяют только к концентрированным растворам, не содержащим поверхностно-активные вещества (ПАВ). Б. Гуи, Д. Чапмен учли тепловое движение в растворах электролитов. Эта теория позволяет рассчитать плотность ?заряда ДЭС и величину дифференциальной емкости С, они учли влияние концентрации, но рассчитанные значения дифференциальной емкости С, но они меньше сходятся с экспериментально полученными результатами. Теория Гуи, Чапмена применима к разбавленным растворам электролитов. Недостатки: 1) не учитываются размеры ионов; 2) не учитывается явление адсорбции на границе раздела фаз. В. Штерн учел, что в электролитах наблюдается электростатическое взаимодействие между ионами, тепловое движение компонентов электролита и возможное специфическое взаимодействие компонентов электролита с поверхностью электрода. Он соединил теорию Гельмгольца с теорией Гуи, Чапмен, в результате ДЭС представлялся состоящим из двух частей: 1) плотной части Гельмгольца; 2) диффузной части по модели Гуи, Чапмена. За счет адсорбции ПА компонента может происходить перезаряд поверхности. Штерн считал, что адсорбция происходит на границе плотной и диффузной части ДЭС. Эта граница называется плоскостью Гельмгольца. Теория Штерна легла в основу современных представлений и развивалась в работах Грема, Фрумкина, Эршлера, Есина и др. Недостатки: 1) не учитывал дискретность зарядов; 2) величина емкости, рассчитанная по модельным представлениям Штерна, не соответствовала экспериментально полученным результатам. Г. Греем рассмотрел возможность адсорбции ПА анионов внутри плотной части ДЭС, он ввел понятие внутренней и внешней плоскости Гельмгольца. Адсорбция анионов происходит на внутренней плоскости Гельмгольца. Недостаток: рассматривал адсорбцию только анионов и не учитывал дискретность зарядов. О. А. Есин рассмотрел дискретность зарядов и показал, что ионы, образующие внутреннюю и внешнюю плоскости Гельмгольца, взаимодействуют между собой, образуя диполи. Указанное взаимодействие влияет на величину диффузной емкости с ДЭС. О. А. Есин рассмотрел возможность адсорбции на внутренней плоскости Гельмгольца как катионов, так и анионов. Поделитесь на страничкеСледующая глава > fis.wikireading.ru Теории строения ДЭС.Количество просмотров публикации Теории строения ДЭС. - 403 Механизм образования и теории строения двойного электрического слоя (ДЭС). Возникновение на межфазной поверхности ДЭС является результатом взаимодействия сопряженных фаз за счёт избыточной поверхностной энергии. Стремление гетерогенной системы к уменьшению поверхностной энергии вызывает определенное ориентирование полярных молекул, ионов или электронов в поверхностном слое, вследствие чего соприкасающиеся фазы приобретают заряды противоположного знака, но равной величины. В результате на границе раздела фаз возникает ДЭС, обуславливающий различные электроповерхностные явления. Различают три возможных механизма образования ДЭС. 1) Поверхностная ионизация – механизм, при котором ДЭС образуется в результате перехода электронов или ионов из одной фазы в другую. К примеру, при эмиссии электронов с поверхности металла образуется электронное облако. Аналогично образуется ДЭС на межфазной поверхности между водой и малорастворимыми соединениями. В воду переходят ионы, которые сильнее гидратируются. В результате на поверхности коллоидных частиц образуется избыток потенциалопределеяющих ионов (ПОИ), который компенсируется избытком ионов противоположного знака (противоионов), локализованных на границе раздела фаз в объёме дисперсионной среды. Данное явление должна быть рассмотрено как автоадсорбция. 2) Образование ДЭС в результате адсорбции. ДЭС может образовываться при избирательной адсорбции в межфазном слое ионов, не входящих в состав вещества дисперсной фазы (адсорбция примесей). Примерами образования ДЭС по данному механизму являются адсорбция ионов электролитов, ионогенных ПАВ. 3) В случае, когда сопряженные фазы не способны обмениваться зарядами, образование ДЭС происходит за счёт ориентирования полярных молекул внутри фаз, обеспечивающего минимальное значение поверхностного натяжения на границе раздела фаз. По этому механизму также может происходить образование ДЭС в результате адсорбции недиссоциированных полярных молекул, находящихся в растворе. ДЭС могут образовывать и неполярные молекулы или атомы, которые могут поляризоваться в поверхностном слое. В этом случае положительно заряжается та фаза, которая имеет большую диэлектрическую проницаемость. Строение ДЭС впервые было представлено Гельмгольцем и Перреном. Согласно их представлениям, на границе раздела фаз заряды располагаются в виде двух рядов разноименно заряженных ионов, подобно обкладке конденсатора. Подобное строение двойного слоя возможно только при отсутствии теплового движения ионов, что не осуществимо в реальных условиях. На основании этого, Гуи и Чепмен предположили, что ДЭС имеет диффузионное (размытое) строение. При этом вероятность нахождения противоионов в диффузионном слое с увеличением расстояния от границы раздела убывает по гиперболической зависимости. При этом данные экспериментов показывают, что при разрушении ДЭС на поверхности частиц находится остаточный заряд противоинов. Следовательно, часть противоионов прочно связана с поверхностью коллоидной частицы. Современная теория строения ДЭС, предложенная Штерном, объединяет положения двух рассмотренных выше теорий. То есть, слой противоионов состоит из двух частей. Одна часть непосредственно примыкает к межфазной поверхности, ее толщина примерно равна радиусу гидратированных ионов. Другая часть противоионов находится в диффузионном слое, его толщина зависит от свойств поверхностного слоя и растворителя. В теории Штерна, в отличие от теории Гельмгольца учтена специфическая (химическая) составляющая адсорбции ионов на поверхности частиц дисперсной фазы. Штерн учел влияние специфической адсорбции ионов на электрический потенциал, обусловленной действием ковалентных связей дополнительно к электростатическим силам. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, заряд слоя Гельмгольца складывается из заряда ионов, адсорбированных за счёт электростатического адсорбционного потенциала и потенциала специфической химической адсорбции, возникающей вследствие наличия на поверхности частиц определенного числа адсорбционных центров. referatwork.ru Поляризация поверхности за счёт внешнего электрического поля.Так происходит поляризация ртутного электрода, погруженного в раствор – электролит.
Строение ДЭС
Современная теория строения ДЭС (развитая в работах Гуи(*), Чапмена(*), Штерна(*), Фрумкина(*), Грэма(*), Гельмгольца(*)) основана на анализе электростатического взаимодействия ионов в ДЭС в сопоставлении с межмолекулярном взаимодействием и тепловым движением ионов.
Согласно этой теории, на поверхности частиц дисперсной фазы возникает заряд вследствие адсорбции потенциалопределяющих ионов или поверхностной ионизации.
В случае адсорбции потенциалобразующих ионов (правило Панета – Фаянса) величина и знак полного термодинамического потенциала φо на поверхности частиц дисперсной фазы зависит от количества и знака адсорбированных ионов. Этот потенциал притягивает противоположно заряженные ионы в растворе.
Одна часть противоионов примыкает непосредственно к заряженной поверхности, образуя плотный (адсорбционный) слой – слой Гельмгольца, толщина плотного слоя d принимается равной радиусу гидратированного противоиона. Эту часть ДЭС можно рассматривать как плоский конденсатор, в котором потенциал, как известно, снижается линейно.
Другая часть противоионов под действием теплового движения распространяется вглубь фазы, образуя так называемый диффузный слой, или слой Гуи. Образовавшийся плоский конденсатор необычен. Расстояние между его "обкладками" равно радиусу ионов, то есть стомиллионным долям сантиметра. Если разность потенциалов равна одному вольту, то напряженность электрического тока достигает при этом миллиона вольт на сантиметр. Это очень высокая напряженность. Даже в мощных электростатических ускорителях заряженных частиц она гораздо меньше. Естественно предположить, что при такой высокой напряженности электрического поля реакционная способность веществ меняется, изменяются вообще химические свойства вещества. На катоде такие поля способны извлечь электроны из металлов и вызвать нейтрализацию катионов. А на аноде они обусловливают начальный акт растворения - переход металла из кристаллической решетки в двойной слой в виде ионов.
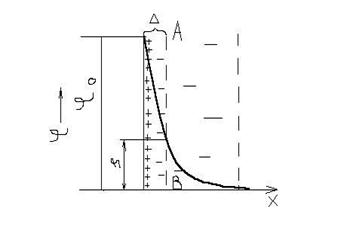
В диффузном слое противоионы распределены неравномерно, поэтому потенциал в диффузной части слоя снижается с расстоянием по экспоненте. j = jd×e-×Х/d (5.2) где jd - потенциал на границе адсорбционного и диффузного слоев; x - расстояние от начала диффузной части ДЭС в глубину жидкой фазы; δ - толщина диффузной части слоя.
За толщину диффузной части слоя δ принимают расстояние, на котором jd уменьшается в е раз (jd/е). Из теории Штерна оно равно:
(5.3) I = ½ SCi×zi2 e - относительная диэлектрическая проницаемость среды, F - постоянная Фарадея, I - ионная сила раствора, Ci- концентрация i – го иона в растворе, zi - заряд иона.
Из уравнения (5.3) следует, что δ уменьшается с ростом концентрации электролита, заряда его ионов и с понижением температуры. Экспериментальных методов измерения j0 не существует.
За толщину диффузной части δ слоя принято расстояние, на котором φоуменьшается в е раз. Толщина диффузной части уменьшается при увеличении концентрации ионов электролита (cio), заряда его ионов (zi) и с понижением температуры (Т):
Суммарный заряд противоионов адсорбционного слоя не полностью компенсирует заряд поверхности частицы, и на границе раздела адсорбционного и диффузного слоев существует заряд, обуславливающий существование потенциала Штерна (φd- потенциала). Строение диффузной части ДЭС определяется соотношением потенциальной энергии притяжения противоионов к заряженной поверхности и кинетической энергии их теплового движения.
Схематическое распределение потенциала в ДЭС см. на рис.5.2:
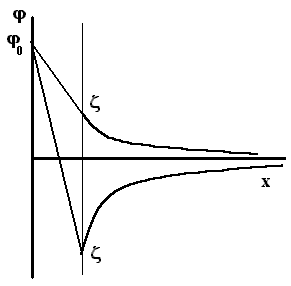
Рис.5.2. Схема распределение потенциала в ДЭС При относительном перемещении фаз происходит разрыв двойного электрического слоя по плоскости скольжения. Разрыв ДЭС может произойти даже вследствие броуновского движения частиц дисперсной фазы. Плоскость скольжения обычно проходит по диффузному слою, и часть его ионов остается в дисперсионной среде. В результате дисперсионная среда и дисперсная фаза оказываются противоположно заряженными.
Потенциал, возникающий на плоскости скольжения при отрыве части диффузного слоя, называют электрокинетическим потенциалом или ζ(дзета)-потенциалом. В общем случае ζ-потенциал всегда меньше φd– потенциала, но для упрощения обычно принимают, что плоскость скольжения делит адсорбционную и диффузную части ДЭС и ζ = φd.
Значение электрокинетического потенциала определяют, изучая электрокинетические явления (обычно электроосмос и электрофорез). Дзета- потенциал, возникающий при электроосмосе или электрофорезе, рассчитывают по уравнению Гельмгольца – Смолуховского
или
где η – вязкость среды; Uo– линейная скорость движения фаз; Е – напряженность электрического поля; Uэф – электрофоретическая подвижность, она равна:
Здесь L – расстояние между электродами: V – разность потенциалов: а – сдвиг границы золь – контактная жидкость за время t. ζ-потенциал – важнейшая характеристика, поскольку определяет скорость перемещения частиц дисперсной фазы и дисперсионной среды и устойчивость золей.
Строение ДЭС можно записать в виде формулы мицеллы золя. Мицелла – электрически нейтральная коллоидная частица. Например, получение золя иодида серебра: AgNO3 + KJ = AgJ + KNO3
Рис.5.3. Двойной электрический слой мицеллы AgJ, полученной при избытке KJ.
Стабилизатором частиц в этом случае выступает ДЭС, образованный неиндифферентными ионами Ag+ или J- и противоионами K+ или NO3- Например, при избытке в растворе ионов иода последние являются неиндифферентными и потенциалопределяющими. Адсорбируясь на поверхности кристалла AgJ, они достраивают кристаллическую решётку и заряжают поверхность своим знаком заряда. В роли противоионов выступают ионы калия, часть которых будет находиться в адсорбционном слое, а другая часть - в диффузном слое.
Для такой системы формулу ДЭС записывают следующим образом:
|← ядро | |←коллоидная частица с зарядом (-х)| |← мицелла (электронейтральна) →|
Коллоидную частицу вместе с двойным электрическим слоем называют мицеллой. Внутреннюю часть мицеллы составляет агрегат - микрокристалл AgJ, состоящий из m пар ионов Ag+ и J-. Агрегат вместе с n потенциалопределяющих ионов (здесь J-) составляет ядро мицеллы. Ядро мицеллы и (n-x) противоионов плотной (адсорбционной) части ДЭС образуют гранулу или частицу. Гранулу окружают x противоионoв диффузного слоя. Если же указанная система получена при избытке нитрата серебра, то неиндифферентными и потенциалопределяющими являются ионы Ag+, и формула мицеллы (строение двойного электрического слоя) имеет вид: {m[AgJ] nAg+ (n-x)NO3-}x+ xNO3-
Мицелла гидрофобного золя BaSO4, стабилизированного BaCl2:
{m [BaSO4] n Ba2+ 2(n-х)Cl-} 2х Cl-
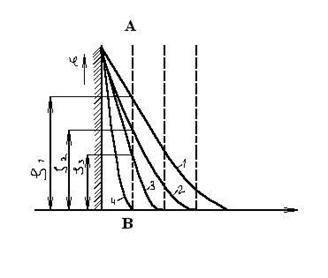
5.4. Факторы, влияющие на величину ζ-потенциала: В общем случае z - потенциал всегда меньше jd потенциала - на границе адсорбционного и диффузного слоев, но для упрощения обычно принимают, что плоскость скольжения проходит именно по границе адсорбционной и диффузной частей ДЭС и z = jd. Таким образом, все факторы, влияющие на jd и толщину d диффузного слоя, изменяют и z - потенциал. Так, согласно уравнениям (5.1) и (5.2), понижение температуры, введение в систему индифферентного электролита (ионы, которого не способны достраивать кристаллическую решетку) и увеличение заряда его ионов ведут к уменьшению толщины диффузного слоя, снижению jd и - электрокинетического потенциала. Рассмотрим подробнее влияние этих факторов.
1. Влияние индифферентных электролитов (не изменяющих φо-потенциал), не содержащих ионы, входящие в состав решетки твердой фазы:
А) в состав входят ионы, сходные с противоионами исходного ДЭС
↑Со =→ ↓δ (сжатие) =→ ↓ ζ-потенциал (кривая 1)
Влияние концентрации такого электролита на величину z - потенциала иллюстрирует рис.5.4.
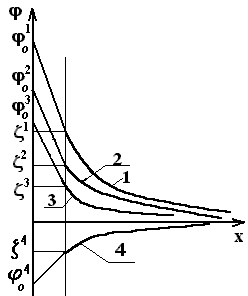
Рис.5.4. Влияние концентрации - С индифферентного электролита на z - потенциал мицелл.
Увеличение концентрации от C1 до C3 уменьшает толщину диффузного слоя (ионы из него переходят в адсорбционный слой) от l1 до l3 и - значение z- потенциала от z1 до z3. При C4 двойной электрический слой состоит лишь из слоя Гельмгольца и z- потенциал равен нулю. Такое состояние коллоидной системы называют изоэлектрическим, а формула ДЭС мицеллы (5.3) в этом случае имеет вид:
{m[AgJ] nJ- nK+}0 Коллоидные системы, находящиеся в изоэлектрическом состоянии, не участвуют в электрокинетических явлениях.
Б) Влияние электролитов, не имеющих общих ионов с противоионами ДЭС мицелл.
Закономерности влияния концентрации таких электролитов на z- потенциал мицелл аналогичны рассмотренным: с увеличением С электрокинетический потенциал уменьшается вплоть до нуля (изоэлектрического состояния).
Рис.5.5. Влияние концентрации электролитов на z - потенциал: 1 – KCl, 2 – CaCl2, 3 –FeCl3 , 4 – ThCl4
При этом ионы добавленного электролита могут вытеснять противоионы адсорбционного слоя ДЭС, замещая их (обменная адсорбция). Особенно свойственно данное явление индифферентным многовалентным ионам, таким как Al+3, Th+4, (РО4)-3, а также - органическим ионам. Они при одинаковой концентрации снижают z- потенциал значительно сильнее, чем рассмотренные выше однозарядные противоионы K+ или NO3- (рис.5.5).
Рис.5.6. Падение потенциала в пределах двойного электрического слоя при перезарядке частицы мицеллы
Ионы одинаковой валентности снижают электрокинетический потенциал в соответствии с их радиусом. Так, известны следующие ряды понижающего действия концентрации ионов на z - потенциал: Li+< Na+< K+< Rb+ Mg+2< Ca+2< Sr+2< Ba+2 Ионы с малым радиусом слабее поляризуются, сильнее гидратируются и поэтому труднее входят в адсорбционную часть ДЭС (для этого им нужно сбросить часть «гидратной шубы», а этот процесс энергетически не выгоден) и в меньшей степени снижают z - потенциал.
2. Влияние неиндифферентных электролитов (способных изменять φо-потенциал), содержащих ионы, которые могут входить в состав решетки твердого тела):
А) ион, способный входить в состав решетки твердого тела имеет тот же знак, что и φо-потенциал .
Рис.5.7. Зависимость электрокинетического потенциала от концентрации неиндифферентных ионов
Например, потенциалопределяющими ионами мицеллы {m[AgJ]nAg+(n-x)NO3-}+xNO3- служат неиндифферентные ионы Ag+, и мы добавляем в систему раствор-электролит AgNO3. При малых концентрациях электролита с увеличением концентрации С электрокинетический потенциал растет за счёт повышения потенциала поверхности j0 при адсорбции на ней неиндифферентных ионов.
При повышенных концентрациях электролита преобладающим становится влияние ионов NO3-, введенных вместе с неиндифферентными - противоионами ДЭС. Они сжимают диффузный слой, вызывая снижение z - потенциала. По этой причине в данном случае зависимость электрокинетического потенциала мицелл от концентрации неиндифферентных ионов имеет экстремум (рис. 5.7). Б) Влияние электролита, содержащего неиндифферентные ионы противоположные по знаку потенциалопределяющим ионам мицеллы. Например, к системе мицелл {m[AgJ]nAg+(n-x)NO3-}+хxNO3- прибавляют электролит KJ, содержащий неиндифферентные ионы J-, противоположные по знаку потенциалопределяющим ионам Ag+. В этом случае адсорбция ионов йода на поверхности агрегата приведёт к снижению j0 потенциала поверхности и тем самым – к снижению и z - потенциала. Это видно из рис. 5.8. На нём увеличение концентрации электролита от С1 до С3 приводит к снижению j0 потенциала от j01 до j03, а z-потенциала – от z1 до z3. В предельном случае при С4 возможна перезарядка коллоидной частицы - z4 при j04.
Рис. 5.8. Падение потенциала в пределах ДЭС мицелл при различных концентрациях неиндифферентных ионов:С4 > С3> C2 > C1 (случай 2)
Похожие статьи:poznayka.org Общие представления о теориях строения дэс. Уравнение Пуассона-Больцмана для диффузной части дэс и его решение для случая слабозаряженных поверхностей. Уравнение Гуи-Чепмена.Экзаменационный билет № 1 Предмет коллоидной химии. Признаки объектов коллоидной химии. Поверхностная энергия и поверхностные явления. Количественные характеристики дисперсности. Классификация дисперсных систем. Коллоидная химия и химическая технология. Коллоидная химия – физическая химия поверхностных явлений и дисперсных систем. Признаки коллоидных систем:
Гетерогенность количественно определяется поверхностным натяжением — величиной, характеризующей энергию единицы поверхности и являющейся фактором интенсивности. Поверхностное натяжение определяет как бы степень гетерогенности, резкость перехода от одной фазы к другой, различие между соприкасающимися фазами. Чем сильнее выражена гетерогенность и чем более резко различаются по природе сопряженные фазы, тем больше поверхностное натяжение. Отсутствие гетерогенности равнозначно отсутствию поверхностного натяжения. Гетерогенным системам присуща поверхностная энергия: G = σ·s. Второй признак — дисперсность. Дисперсность – величина, обратная поперечному размеру частиц: D=1/а. Системы с малой дисперсностью (менее 103 см-1) не принято рассматривать как коллоидные. Широко применяется и третья характеристика раздробленности — удельная поверхность Sуд, определяемая отношением площади межфазной поверхности к объему тела s/V, Все три характеристики раздробленности связаны между собой: с уменьшением размера а увеличиваются дисперсность D и удельная поверхность Sуд. Классификация по кинетическим свойствам:
Классификация по размеру частиц:
Коллоидные явления широко распространены в химической технологии. Практически нет такого химического производства, которое бы не осуществлялось с участием поверхностных явлений и дисперсных систем. Измельчение сырья и промежуточных продуктов, обогащение, в том числе флотация, сгущение, отстаивание и фильтрация, конденсация, кристаллизация и вообще процессы образования новых фаз, брикетирование, спекание, гранулирование — все эти процессы протекают в дисперсных системах, и в них большую роль играют такие коллоидно-химические явления, как смачивание, капиллярность, адсорбция, седиментация, коагуляция. Большое распространение в химической технологии получили адсорбенты и катализаторы, которые представляют собой дисперсные системы с твердой дисперсионной средой. Адсорбция имеет самостоятельное значение для очистки и разделения веществ, извлечения ценных компонентов, хроматографии и др. Как правило, все гетерогенные процессы в химической технологии для увеличения их скорости проводят при максимальной поверхности контакта фаз. Это значит, что системы в реакционных аппаратах находятся в состоянии суспензий, паст, пульп, эмульсий, пен, порошков, туманов, пылей. Несмотря на то что толщина поверхностных слоев не превышает несколько молекул, их роль не менее важна, чем объемных фаз, например, в процессах массопередачи (адсорбция, экстракция, сушка, испарение и др.), термоэлектронной эмиссии, смазочном действии, адгезии. Все электрические свойства межфазных поверхностей и явления, протекающие на них, обусловлены наличием двойного электрического слоя на границе раздела фаз. Количественные связи между параметрами двойного электрического слоя определяются его строением. Первые предположения об образовании двойного электрического слоя были сделаны Квинке. Строение двойного электрического слоя впервые было представлено Гельмгольцем и Перреном по аналогии со строением плоского конденсатора. Согласно их представлениям, на границе соприкасающихся фаз заряды располагаются в виде двух рядов разноименных ионов: ряд потенциалопредвляющих ионов на расстоянии, равном их радиусу в несольватированном состоянии, и прилегающий к нему ряд противоионов. Толщина электрического слоя близка к молекулярным размерам или размерам сольватированных ионов. Потенциал слоя снижается в пределах его толщины линейно до нуля. Поверхностный заряд qs определяется в соответствии с теорией плоского конденсатора уравнением:
Вполне естественно, что подобное строение двойного слоя возможно при отсутствии теплового движения ионов. В реальных же условиях распределение зарядов на границе раздела фаз в первом приближении определяется соотношением сил электростатического притяжения ионов, зависящего от электрического потенциала φ0 и теплового движения ионов, стремящихся равномерно распределиться во всем объеме жидкой или газообразной фазы. К такому выводу независимо друг от друга пришли Гуи и Чепмен. Они предположили, что двойной электрический слой имеет диффузное (размытое) строение и все противоионы находятся в диффузной его части — в диффузном слое. Поскольку протяженность диффузного слоя определяется кинетической энергией ионов, то в области температур, близких к абсолютному нулю, все противоионы будут находиться в непосредственной близости к потенциалопределяющим ионам. Современная теория строения двойного электрического слоя основана на представлениях Штерна. Она объединяет две предыдущие теории. Согласно современной теории слой противоионов состоит из двух частей. Одна часть примыкает непосредственно к межфазной поверхности и образует адсорбционный слои (слой Гельмгсиьца) толщиной δ, которая равна радиусу гидратированных ионов, его составляющих. Другая часть противононов находится в диффузной части — диффузный слой (слой Гуи) с потенциалом φδ, толщина λ которой может быть значительной и зависит от свойств и состава системы. Потенциал в диффузной части двойного электрического слоя не может зависеть линейно от расстояния, так как ионы в нем распределены неравномерно. В соответствии с принятыми представлениями потенциал в слое Гельмгольца при увеличении расстояния от слоя потенциалопределяющих ионов снижается до потенциала диффузного слоя линейно, а затем, как будет показано, по экспоненте. Теория Штерна учитывает также специфическую (некулоновскую, химическую) составляющую адсорбции ионов на поверхности раздела фаз, которая существенным образом может влиять на изменение потенциала. Уравнение Пуассона — Больцмана:
Это уравнение после двойного интегрирования дает соотношение, выражающее закон изменения поверхностного потенциала от расстояния в диффузной части двойного электрического слоя и от свойств раствора. Чтобы в полной мере представлять возможности этого соотношения, лежащего в основе теории двойного электрического слоя, необходимо учитывать основные допущения и предположения, принятые Гуи и Чепменом при его выводе: двойной электрический слой является плоским, диэлектрическая проницаемость не зависит от расстояния х, ионы представляют собой точечные заряды (т. е. не имеют объема), при переводе противоионов из объема раствора в двойной электрический слой совершается работа только против электростатических сил. Обычно уравнение Пуассона — Больцмана решают применительно к конкретным граничным условиям. Ниже приводится его решение при условии малости потенциала диффузного слоя (φδ<<25 мВ). Обозначим экспоненциальный показатель у фактора Больцмана через у. При малых значениях φ и соответственно y<<1 фактор Больцмана можно разложить в ряд Маклорена:
Если ограничиться двумя первыми членами ряда, то уравнение для объемной плотности заряда после этих преобразований примет вид:
Первый член правой части этого уравнения равен нулю. так как он включает сумму зарядов в объеме раствора, которая по условиям электронейтральности равна нулю, и поэтому окончательно имеем:
После такого преобразования уравнение Пуассона — Больцмана принимает следующую форму:
Выражение æ2 перед φх включает постоянные, характеризующие свойства раствора, поэтому можно считать, что они не изменяются с расстоянием от поверхности:
Окончательно имеем: Если расстояние х отсчитывать от начала диффузной части двойного электрического слоя, то Последние уравнения называются уравнениями Гуи-Чепмена, из них следует, что потенциал в области диффузного слоя в зависимости от расстояния уменьшается по экспоненте. studfiles.net Строение двойного электрического слоя. Потенциалы ДЭССовременная теория строения двойного электрического слоя основана на представлениях Штерна. Она объединяет две предыдущие теории. Согласно современной теории слой противо ионо состоит из двух частей (рис. П. 13). Одна часть находится в непосредственной близости к межфазной поверхности и образует слои Гельмгольца (адсорбционный слой) толщиной б не более диаметра гидратированных иоиов, его составляющих. Другая часть противоионов находится за слоем Гельмгольца, в диффузной части (диффузный слой Гуи с потенциалом ф ), толщина I которой может быть значительной и зависит от свойств и состава системы. Потенциал в диффузной части двойного электрического слоя не может зависеть линейно от расстояния, так как ионы в нем распределены неравномерно. В соответствии с принятыми представлениями иотенциал в слое Гельмгольца при увеличении расстояния от слоя потенциалопределяющих ионов сни- [c.54]Рнс, 12,2, Строение двойного электрического слоя по Гуи — Чапману молекулярная картина (а) и изменение потенциала с расстоянием от поверхности металла в глубь раствора (6 [c.264] Строение двойного электрического слоя в условиях специфической адсорбции. Адсорбция — концентрирование вещества из объема фаз на поверхности раздела между ними — может быть вызвана как электростатическими силами, так и силами межмолекулярного взаимодействия и химическими. Адсорбцию, вызванную силами неэлектростатического происхождения, принято называть специфической. Вещества, способные адсорбироваться на границе раздела фаз, называются поверхностно-активными (ПАВ). К ним относятся большинство анионов, некоторые катионы и многие молекулярные соединения. Специфическая адсорбция ПАВ, содержащегося в электролите, влияет на структуру двойного слоя и величину ф1 потенциала (рис. 172). Кривая 1 на рис. 172 соответствует распределению потенциала в двойном электрическом слое в отсутствие ПАВ в растворе. Если раствор содержит вещества, дающие при диссоциации поверхностно-активные катионы, то за счет специфической адсорбции поверхностью металла катионы будут входить в плотную часть двойного слоя, увеличивая ее положительный заряд (кривая 2). В условиях, способствующих усилению адсорбции (например, увеличение концентрации адсорбата), в плотной части может оказаться избыточное количество положительных зарядов по сравнению с отрицательным зарядом металла (кривая 3). По кривым распределения по- [c.474] Первая иоиытка количественного оформления теории замедленного разряда была предпринята Эрдей-Грузом и Фольмером в 1930 г., хотя некоторые ее положения уже содержались в работах Батлера (1924) и Одюбера (1924). Эрдей-Груз и Фольмер вывели формулу, связывающую потенциал электрода иод током с плотностью тока. Выведенная ими формула является основным уравнением электрохимического перенапряжения и согласуется с эмпирическим уравнением для перенапряжения водорода. Однако теория замедленного разряда в ее первоначальном виде содержала ряд недостаточно обоснованных допущений и не могла удовлетворительно описать всю совокупность опытных данных. Наибольший вклад в теорию замедленного разряда был внесен А. Н. Фрумкиным (1933), который впервые учел влияние строения двойного электрического слоя на кинетику электрохимических процессов. Его идеи во многом определили основное направление развития электрохимической науки и ее современное состояние. [c.345] Появление оксида на иоверхности металла изменяет строение двойного электрического слоя. В этом случае его уже нельзя представить простой моделью Штерна — Грэма, которая использовалась ири создании теории водородного перенапряжения. В этом случае, по Гэру и Ланге (1958 , к падению потенциала в гельмгольцевской и диффузной частях дво1И1ого слоя, учитываемых в модели Штерна Грэма, следует добавить падеиие потенциала в слое оксида (рис. [c.427] Метод электрокапиллярных кривых [1—5]. Строение двойного электрического слоя исследуют методом электрокапиллярных кривых. Он связан зависимостью поверхностного натяжения на границе раствор — твердое тело (электрод) от потенциала электрода. Последний, в свою очередь, определяется строением двойного электрического слоя. [c.171] Строение двойного электрического слоя (д. э. с.) имеет большое значение в кинетике электродных процессов. Равновесные потенциалы не зависят от строения д. э. с. Это объясняется тем, что равновесные электродные потенциалы определяются химическими потенциалами атомов металла в глубине электрода и ионов металла в глубине раствора электролита. Скорость электрохимической реакции, ее механизм и влияние на нее различных факторов зависят от строения двойного электрического слоя. Двойной электрический слой может образоваться при обмене ионами между электродом и раствором электролита. Если химический потенциал ионов в растворе электролита больше, чем атомов в металле, то выделившиеся на поверхности электрода ионы притягивают к себе анионы из раствора. Одной обкладкой д. э.с. служат положительные заряды со стороны металла, другой обкладкой — отрицательные заряды анионов со стороны раствора. Наоборот, если химический потенциал атомов в металле больше химического потенциала его ионов в растворе, то. перешедшие из металла в раствор ионы притянутся к его поверхности избыточными электронами. При этом также об- разуется двойной электрический слой, но с противоположным расположением заряда. Обкладка д. э. с. со стороны металла заряжена отрицательно (избыточные электроны), а со стороны раствора электролита — положительно (катионы). [c.299] Часто процессы электровосстановления анионов носят необратимый характер. Если стандартный потенциал окислительно-восстановительной системы соответствует значительному положительному заряду электрода, то процесс электровосстановления также может начаться при 0 ( , =о)- Эти системы [к ним относятся системы (I) — (111)1 представляют наибольший интерес с точки зрения установления связей между строением двойного электрического слоя и кинетикой электродных процессов. В самом деле, именно при переходе через п. н. 3. происходит наиболее существенная перестройка двойного слоя, которая может оказать влияние как на скорость стадии разряда [c.263] Уравнения (386) и (387) справедливы для любого окислительновосстановительного электрода и показывают зависимость скоростей электродных процессов от потенциала и строения двойного электрического слоя. При этом видно, что на скорость электродного процесса оказывает влияние только часть общего скачка потенциала, приходящаяся на плотную часть двойного электрического слоя (т. е. на зону, где протекает электрохимическая реакция), гр = (Ум.)обр + А1/ — г] . [c.201] Строение двойного электрического слоя не имеет значения для величины обратимого электродного потенциала, которая определяется изменением изобарно-изотермического потенциала соответствующей электрохимической реакции. В то же время строение двойного электрического слоя играет важную роль в кинетике электродных процессов, в том числе и в кинетике обмена ионами в равновесных условиях, характеризуя интенсивность этого обмена (величину тока обмена о). [c.157] Таким образом, величины Qj и зависят от потенциала металла Уме = Уме)обр + АУ и строения двойного электрического слоя на границе металл—раствор,так как Qi и Qa = / ipj), а il определяется строением двойного электрического слоя. [c.200] Изучение кинетики адсорбции поверхностно активных веществ при достаточной скорости электродной реакции показывает, что концентрирование различных веществ на электродах, а значит, и состояние адсорбционного слоя очень сильно зависят от конкретных условий электролиза, свойств металла и раствора и, следовательно, от строения двойного электрического слоя (потенциала ионного слоя). [c.354] Рассмотрим строение двойных электрических слоев в разных точках электрокапиллярной кривой при отсутствии и в присутствии в растворе поверхностно-активных молекул (рис. 84, / и II). Точка f соответствует потенциалу нулевого заряда в присутствии поверхностно-активных молекул в растворе. Она расположена при том же потенциале, что и точка Ь на кривой 1, в которой поверхность ртути заряжена положительно. Разность потенциалов ф — ф равна адсорбционному Ч-потенциалу. Положительное значение адсорбционного 1з1-потенциала указывает на то, что молекулы органического вещества обращены к поверхности ртути положительным концом диполя. Другие органические вещества могут быть обращены к поверхности ртути отрицательным концом диполя, что приведет к сдвигу максимума электрокапиллярной кривой в сторону отрицательных потенциалов. [c.306] Строение двойного электрического слоя у сферических частиц. Для сферических частиц при сравнительно небольших значениях потенциала падения потенциала с расстоянием было дано Дебаем и Гюккелем [c.190] Адсорбция поверхностно-активных веществ происходит при значениях потенциалов, лежащих в определенной области. При любом потенциале в этой области, кроме точки нулевого заряда, двойной электрический слой создается за счет сил электростатического Притяжения противоионов и сил адсорбции. Поэтому такой слой имеет сложное строение. Область потенциалов, в которой наблюдается адсорбция поверхностно-активных веществ, определяется сравнением электрокапиллярных кривых, снятых для чистого раствора и для раствора с добавкой адсорбирующихся веществ. Таким образом, по изменению формы электрокапиллярных кривых и величине потенциала нулевого заряда можно судить о строении двойного электрического слоя. [c.172] Дайте характеристику строения двойного электрического слоя на поверхности раздела фаз. Как изменяется потенциал с расстоянием от поверхности [c.102] Достаточно полное представление о строении двойного электрического слоя дают кривые изменения дифференциальной емкости с изменением электродного потенциала, на ход которых резкое влияние оказывают поверхностноактивные вещества. [c.104] При специфической и ориентированной адсорбции двойной электрический слой, в отличие от случая обмена ионами, целиком расположен внутри одной из фаз. Обмен ионами, специфическая и ориентированная адсорбции могут сопутствовать друг другу, что приводит к сложному строению двойного электрического слоя. Например, при одновременном обмене ионами и значительной специфической адсорбции возможна перезарядка поверхности с изменением знака г 3 -потенциала (рис. 12.3). Скачок потенциала между металлом и раствором называют абсолютным электродным потенциалом. [c.230] Анализ данных, представленных в табл. 45, показал, что ингибиторы Реакор-11 ЮА и СПМ-1 проявляют смешанный эффект торможения, вызывая снижение тока коррозии в результате уменьшения площади поверхности металла, на которой протекает катодная реакция водородной деполяризации, а также изменяя строение двойного электрического слоя на границе металл-коррозионная среда и величину адсорбционного Ч, -потенциала. Ингибиторы Реакор-11 ЮСП и СПМ-2 замедляют коррозию стали за счет реализации Ч, -эффекта, то есть характеризуются энергетическим воздействием на поверхность металла. [c.301] Существование между твердым телом и раствором наряду с общим скачком потенциала также -потенциала следует учитывать при разработке теории строения двойного электрического слоя. Эта теория должна объяснить не только причины появления элек-трокинетического потенциала, но и характер его изменения с составом раствора и, в частности, явление перезарядки поверхности. [c.234] Эти и многие другие экспериментальные результаты с полной определенностью показывают, что электрохимический потенциал (а следовательно, и фо) и -потенциал не совпадают. Этот факт противоречит представлениям о молекулярном строении двойного электрического слоя. [c.145] Распределение потенциала в ионной обкладке двойного электрического слоя представлено на рис. 171, II. Величина сКачка потенциала на границе раствор —металл складывается из падения потенциала ф в плотной части двойного слоя и падения потенциала ф1 в диффузной. Строение двойного электрического слоя определяется общей концентрацией с раствора. С ее увеличением процессы, способствующие формированию диффузной части, ослабляются, раз- [c.473] На границе раствор — воздух наблюдаются как явления адсорбции, большой вклад в исследование которых внесли работы И. Лэнгмюра и Н. Адама, так и пространственное разделение зарядов разного знака. Последнее может быть зафиксировано в виде изменения поверхностного потенциала при изменении состава раствора. Поэтому совместное изучение явлений адсорбции и изменения поверхностных скачков потенциала позволило получить основные сведения о строении двойного электрического слоя на свободной поверхности раствора. [c.88] При выводе уравнения (У.31) влияние строения двойного электрического слоя не учитывалось. Следовательно, оно является справедливым для растворов достаточно концентрированных (свыше 0,1 М) или содержащих значительный избыток индифферентного электролита при отсутствии поверхностно-активных веществ и при заметном удалении потенциала электрода от потенциала нулевого заряда. [c.135] Итак, метод измерения дифференциальной емкости позволяет определять п. н. 3., находить зависимость заряда поверхности от потенциала, а также рассчитывать величины адсорбции органического вещества и специфической адсорбции ионов в растворах с постоянной ионной силой. Метод применим как к жидким, так и к твердым электродам и является чрезвычайно чувствительным к любым изменениям в строении двойного электрического слоя. Последнее обстоятельство предъявляет очень высокие требования к чистоте исследуемых этим методом металлов и растворов. Существенным препятствием для использования метода измерения емкости является возможность протекания электрохимических реакций на границе электрод — раствор. [c.60] Строение двойного электрического слоя по Гуи — Чэпмену и падение потенциала в этом слое схематически изображены на рис. vn, 9. Потенциал на этой схеме падает не по прямой, а по кривой в связи с тем, что компенсирующие заряд стенки противоионы распределены неравномерно. Падение кривой круче в тех местах, где больше компенсирующих противоионов, и, наоборот, кривая более полога там, где компенсирующих противоионов мало. [c.177] Первые предположения о его образовании были сделаны Квинке. Строение двойного электрического слоя впервые было представлено Гельмгольцем и Перреном по аналогии со строением плоского конденсатора. Предполагалось, что, как и в плоском конденсаторе, на границе соприкасающихся фаз заряды располагаются в виде двух рядов разноименных ионов. Толщина слоя считалась близкой к молекулярным размерам или размерам сольватированных ионов. Потенциал слоя снижается на этом расстоянии линейно до нуля. Поверхностный заряд теорией плоского конденсатора уравнением (11.80) [c.54] Существенной особенностью стадии разряда — ионизации является, то, что скорость перехода заряженной частицы через границу раздела зависит от строения двойного электрического слоя. С физической точки зрения эта зависимость обусловлена двумя факторами 1) изменением энергии активации, которая определяется скачком потенциала в плотной части двойного слоя 2) изменением концентрации реагирующего вещества в двойном электрическом слое. Как следует из общего уравнения поляризационной кривой [см. формулы (48.1) и [c.251] Для изучения строения двойного электрического слоя, а также кинетики и механизма электродных процессов важно знать не абсо-лю тное значение скачка потенциала на границе электрод — раствор, а его изменение, которое доступно опытному определению. [c.105] Л. Н. Фрумкин и сотр. показали, что перенапряжение перехода определяется строением двойного электрического слоя на границе раствор — металл. Можно полагать, что электрохимическая реакция протекает только при непосредственном соприкосновении реагирующих частиц с электродом, так как переход электронов на значительное расстояние маловероятен. С этой точки зрения следует считать ре-акционноспособными частицы, расположенные только в плотной части двойного электрического слоя (см. 174). Поэтому при расчете перенапряжения следует учитывать не электродный потенциалу и концентрацию реагирующих веществ в массе электролита, а падение потенциала и концентрацию реагирующих ионов в плотной части двойного слоя. Тогда в уравнение (184.17) входит дополнительный член, содержащий фгпотенциал [c.508] Изменения в строении двойного электрического слоя не влияют на равновесный потенциал, если остаются постоянными химические потенциалы веществ, участвующих в электродной реакции внутри фаз. Например, при добавлении к раствору поверхностно-активного вещества появляется новый адсорбционный двойной электрический слой и соотвеитвующий скачок потенциала. [c.300] Если 11)1-потенциал имеет положительное значение, как, например, лри разряде катиона, то ток обмена уменьшается если j3i-noTeH-циал отрицательный, то увеличивается. Через ф1-потенциал можно установить зависимость перенапряжения и скорости электрохимической реакции (тока) от строения двойного электрического слоя н состава раствора. [c.390] Следует заметить, что при выводе уравнений (VII, 42) и УП,44) был сделан ряд упрощений и не вполне обоснованных допущений. Прежде всего, как уже было указано при рассмотрении строения двойного электрического слоя, схему, из которой мы исходили, нельзя считать удовлетворительной. Двойной электрический слой, согласно новейшим представлениям, надо представлять не плоскопараллельным конденсатором, а конденсатором, одна из обкладок которого состоит из диффузно распределенных ионов. Часть этих ионов -находится в приповерхностном слое и отстоит от твердой поверхности на меньшем расстоянии, чем плоскость скольжения. В результате этого электрокинетический потенциал соответствует не всему заряду на поверхности стенки, а разности между общим поверхностным зарядом и зарядом всех ротивоионов, находящихся в приповерхностном слое. Поведение такого слоя при электрофорезе или электроосмосе следует представлять себе так, как это показано на рис. VII, 19 б. Правда, такое представление о двойном электрическом слое не обесценивает приведенный вывод, так как этот слой по-прежнему можно рассматривать как электрический конденсатор. Возникает лишь вопрос о том, насколько допустимо при количественных выводах приравнивать расстояние I, на котором происходит изменение скорости течения жидкости в двойном слое, к усредненному расстоянию между обеими обкладками электрического конденсатора с размытой внешней обкладкой. [c.201] Сущность работы. Знание зависимости поверхностного натяжения на границе раствор — металл от приложенного напряжения иоз воляет судить о строении двойного электрического слоя. Для исследования применяют метод электрокапиллярных кривых. Ето сущность состоит в постепенной поляризации ртутного катода и измерении поверхностного натяжения на границе раствор — ртуть. При катодной иоляризации ртути ее положительный заряд постепенно уменьшается, а поверхностное натяжение возрастает. При заряде, равном нулю, иоверхностное натяжение достигает максимума. Форма получаемой электрокапилляр-ной кривой и потенциал нулевого заряда, при котором поверхностное натяжение достигает максимальното значения, определяется составом раствора, наличием в нем поверхностно-активных веществ и, следовательно, природой и строением двойного электрического слоя. [c.184] Таким образом, электрокинетические и электрокапилляр-нь(б явления, устанавливая изменение заряда поверхности электрода с изменением электродного потенциала при введении или в отсутствие специфически адсорбирующихся ионов либо молекул, дают определенные представления о строении двойного электрического слоя. [c.101] Из всего вышесказанного не следует делать вывод о том, что основная причина коагуляции заключается в достижении некоторого постоянного для всех случаев критического дзета-потенциала. Исследования последних лет, проведенные советскими учеными В. В. Дерягиным и его сотрудниками, показали, что коагулирующее действие электролитов заключается не столько в непосредственном уменьшении сил отталкивания между коллоидными частицами через понижение дзета-потенциала, сколько в том, что изменение строения двойного электрического слоя и сжатие диффузной его части, обусловленное прибавлением электролита-коагулянта, влечет за собой понижение расклинивающего действия гидратных (сольватных) оболочек диффузных ионов, разъединяющих коллоидные частицы. Иными словами, необходимое для коагуляции данного золя понижение расклинивающего действия (или давления) сольватных оболочек достигается уменьшением диффузного слоя противоионов, что ведет к соответствующему понижению величины дзета-потен-адиала. [c.371] Если говорить о дальнейшем развитии наших представлений в области строения двойного электрического слоя, то следует указать, что после теорий Гуи и Штерна, каких-либо общих теорий подобного масштаба не появлялось, хотя и были попытки построения отдельных аспектов теории двойного слоя с использованием методов термодинамики необрати-мых процессов и статистики. Предлагались некоторые уточнения картины строения двойного слоя, представленной Штерном. Так, например, Грэм предложил провести подразделе- ние внутренней части двойного слоя для слу- чая, когда имеет место специфическая адсорб- ция наряду с адсорбцией ионов за счет электростатических сил. Такое подразделение приводит к тому, что выделяется отдельно плоскость, проходящая через центры специфически адсорбированных ионов, со значением потенциала и плоскость, проходящая через центры неспецифически адсорбированных ионов, со значением потенциала г зв. Это позволяет уточнить величину поправки на объем ионов, входящих в двойной слой, что не учитывалось классическими теориями. Схема строения двойного электрического слоя, согласно Штерну и Грэму, а именно, его внутренней части (гельмгольцевский слой), приведена на рис. 23. [c.45] chem21.info Строение ДЭС | Бесплатные курсовые, рефераты и дипломные работыЭлектрокинетические явления ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА КОЛЛОИДНЫХ СИСТЕМ
К электрокинетическим явлениям относятся электрофорез, электроосмос, потенциал седиментации и потенциал течения. Первые два явления открыты в 1808 г. Ф. Ф. Рейссом, вторые несколько позже: потенциал седиментации — Дорном в 1878 г. (иногда его называют эффектом Дорна), потенциал протекания — Квинке в 1859 г. Электрофорезом называется движение частиц дисперсной фазы относительно дисперсионной среды под действием внешнего электрического поля. Электрофорез можно наблюдать в U-образной трубке, заполненной дисперсной системой с жидкой дисперсионной средой. Если в U-образной трубке поставить кварцевую диафрагму, то при наличии внешнего электрического поля будет наблюдаться движение дисперсионной … среды к отрицательному электроду. Это явление называется электроосмосом. Оба явления обусловлены наличием заряда на поверхности раздела частица–жидкость или жидкость – мембрана. Потенциал течения возникает при движении жидкости через пористую диафрагму под влиянием приложенной извне силы и распределяется по длине диафрагмы. Это явление по своей физической сути противоположно электроосмосу. Потенциал седиментации возникает при осаждении частиц в гравитационном поле, распределяется по длине трубки и по своей сути противоположен электрофорезу. По современным представлениям заряд коллоидных частиц лиозолей обусловлен существованием на их поверхности двойного электрического слоя, или сокращенно ДЭС, который возникает за счет избирательной адсорбции одного из ионов раствора или за счет ионизации поверхностных молекул вещества. Выглядит это следующим образом. Пусть в растворе KI находятся кристаллы AgI. Иодид-ионы как потенциалопределяющие будут достраивать кристаллическую решетку частиц, заряжая их отрицательно. Противоионы калия находятся в растворе вблизи межфазной границы. Весь комплекс нейтрален, называется мицеллой и изображается в виде формулы [nAgImI—(m-x)K+]xK+. Возникновение ДЭС по второму механизму происходит на частицах водного золя диоксида кремния. В этом случае диоксид гидратируется с образованием кремниевой кислоты, которая диссоциирует по схеме : h3SiO3 = SiO32- + 2H+. Ионы водорода переходят в раствор, а поверхность заряжается отрицательно.
ДЭС обычно рассматривают как конденсатор, состоящий из двух обкладок, одна из них связана с дисперсной фазой, другая с дисперсионной средой.
Рис. 7.1. Схема ДЭС по Гельмгольцу Поверхностный заряд определяется по формуле
где e – абсолютная диэлектрическая проницаемость среды между обкладками, j0 – разность потенциалов между дисперсной фазой и раствором, d – расстояние между обкладками. Позже появилась теория Гуи–Чэпмена, причем каждый из ученых предложил ее независимо от другого. По представлениям этой теории ДЭС состоит из плотной и диффузной частей. Диффузная часть возникает из-за теплового движения ионов, благодаря ее наличию падение потенциала в ДЭС имеет криволинейный характер. На рис. 7.2 представлена схема строения ДЭС по Гуи–Чэпмену. Число противоионов по мере удаления от границы раздела уменьшается в соответствии с законом распределения Больцмана и для точки с потенциалом jч определяется по формулам
С+ = С ¥ exp (-Fz jч /RT ), (7.2) C— = C exp ( Fz jч /RT ),
где z – валентность иона, С+,С— – концентрация катиона и аниона, соответственно, С¥ – концентрация для точки j¥ = 0. Линия АВ на рис. 7.2 – это граница скольжения при перемещении жидкой и твердой фаз. В этой точке реализуется потенциал z (дзета-потенциал), или электрокинетический потенциал. Именно этот потенциал определяет перемещение фаз при наложении электрического поля. Если ввести в систему индифферентный электролит, то общий скачок потенциала не изменится. Однако при этом будет уменьшаться толщина диффузного слоя, так как для компенсации заряда потенциалопределяющих ионов требуется одно и то же число противоионов. Происходит сжатие ДЭС и меняется распределение в нем потенциала. Изменяется и дзета-потенциал, как это наглядно представлено на рис. 7.3.
Рис. 7.2. Строение ДЭС по Гуи-Чэпмену Рис. 7.3. Влияние индифферентного электролита на толщину ДЭС и дзета-потенциал (концентрация электролита растет от 1 к 4) При некоторой концентрации дзета-потенциал исчезает (кривая 4). Теория Гуи–Чэпмена не объясняет целый ряд фактов, таких как влияние многовалентных ионов, ионов разной природы на дзета-потенциал. Она неприемлема для концентрированных коллоидных растворов. В 1924 году была предложена теория Штерна, которая объединила обе рассмотренные выше теории. По Штерну, несколько первых слоев противоионов притягиваются к стенке под влиянием электростатических и адсорбционных сил, так что часть противоионов находится близко у поверхности и образует плоский конденсатор толщиной d. В этом слое, который часто называют слоем Гельмгольца, наблюдается резкое падение потенциала. Остальные противоионы образуют диффузную часть ДЭС, которую называют слоем Гуи. refac.ru |
|
||||||||||||||||||
|
|
||||||||||||||||||
|




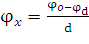 (5.1)
(5.1)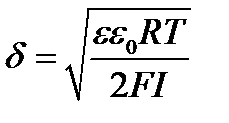
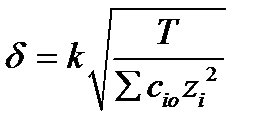
 (k – коэффициент пропорциональности, включающий диэлектрические постоянные среды и вакуума, универсальную газовую постоянную R и число Фарадея F). Значения δ для сильно разбавленных растворов электролитов составляют десятки нанометров, т.е. намного превосходят размеры молекул и ионов в растворе.
(k – коэффициент пропорциональности, включающий диэлектрические постоянные среды и вакуума, универсальную газовую постоянную R и число Фарадея F). Значения δ для сильно разбавленных растворов электролитов составляют десятки нанометров, т.е. намного превосходят размеры молекул и ионов в растворе.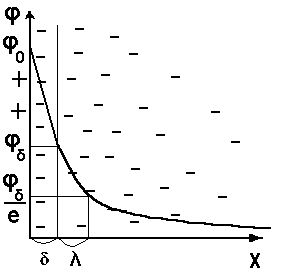
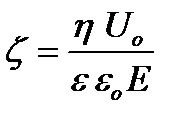
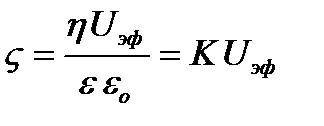 , (5.5)
, (5.5)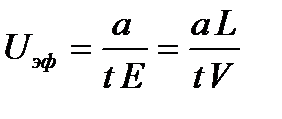 . (5.6)
. (5.6)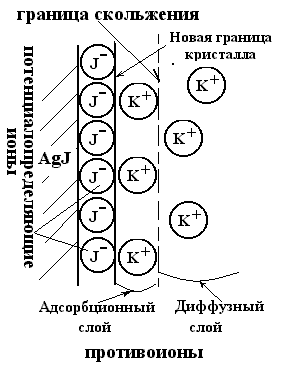 производят в избытке либо AgNO3, либо KJ.
производят в избытке либо AgNO3, либо KJ.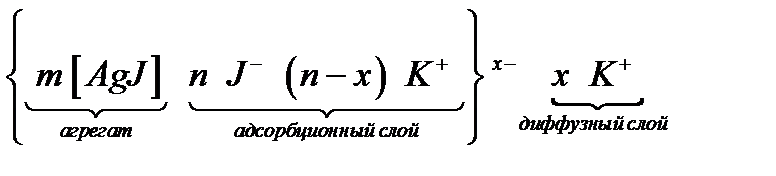 , где m>>n
, где m>>n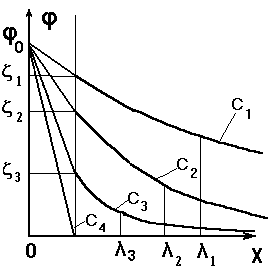

 Это объясняется тем, что многозарядные ионы обладают большей адсорбционной способностью, сильнее притягиваются заряженным ядром мицеллы. Войдя в адсорбционный слой ДЭС, они компенсируют сразу несколько зарядов поверхности, вызывая изоэлектрическое состояние при существенно меньших концентрациях, чем одновалентные ионы. Они способны не только полностью скомпенсировать заряд ядра, но и перезарядить коллоидные частицы (рис. 5.6).
Это объясняется тем, что многозарядные ионы обладают большей адсорбционной способностью, сильнее притягиваются заряженным ядром мицеллы. Войдя в адсорбционный слой ДЭС, они компенсируют сразу несколько зарядов поверхности, вызывая изоэлектрическое состояние при существенно меньших концентрациях, чем одновалентные ионы. Они способны не только полностью скомпенсировать заряд ядра, но и перезарядить коллоидные частицы (рис. 5.6).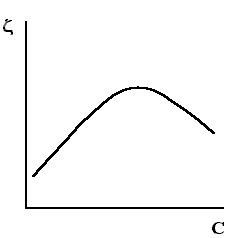
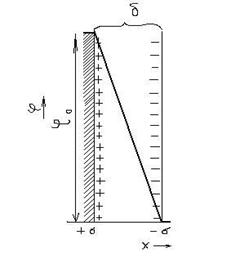 По теории Гельмгольца ДЭС – это плоский конденсатор, одна из обкладок которого находится на поверхности твердого тела, другая с противоположным зарядом — в жидкости. Падение потенциала в такой модели линейно. Схема такого слоя представлена на рис. 7.1.
По теории Гельмгольца ДЭС – это плоский конденсатор, одна из обкладок которого находится на поверхности твердого тела, другая с противоположным зарядом — в жидкости. Падение потенциала в такой модели линейно. Схема такого слоя представлена на рис. 7.1.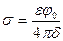 , (7.1)
, (7.1)