Содержание
Какие вещества проводят электричество? | Эксперимент
На этом практическом занятии учащиеся проверяют электропроводность ковалентных и ионных веществ в твердом и расплавленном состояниях
Этот эксперимент позволяет учащимся различать электролиты и неэлектролиты и убедиться, что ковалентные вещества никогда не проводят электричество, даже когда они сжижены. тогда как ионные соединения проводят в расплавленном состоянии.
Практические работы хорошо подходят для классного эксперимента, когда учащиеся работают в группах по два-три человека. На исследование всех веществ не будет времени, поэтому каждой группе можно назначить три или четыре из них, а в конце результаты объединить.
Оборудование
Аппаратура
- Защита глаз
- Электроды угольные (графитовые), вставленные в держатель (см. примечание 1 ниже)
- Горелка Бунзена
- Штатив
- Треугольник для трубной глины
- Термостойкий мат
- Зажим и подставка
- Маленькие кусочки наждачной бумаги
- Соединительные провода и зажимы типа «крокодил»
- Блок питания постоянного тока, 6 В
- Лампочка в патроне, 6 В (см.
примечание 2 ниже)
Примечания к аппарату
- Угольные электроды должны быть закреплены в какой-либо опоре, например, в полиэтиленовом держателе или большой резиновой пробке, чтобы исключить возможность короткого замыкания электродов. Электроды необходимо закрепить таким образом, чтобы они поместились внутри поставляемого тигля.
- Лампа имеет больший визуальный эффект, но вместо нее можно использовать амперметр.
Химикаты
- Мелкие кусочки свинца (ТОКСИЧЕСКИЕ), меди и, возможно, других металлов
- Тигли, содержащие образцы:
- Фенилсалицилат (салол) (РАЗДРАЖАЮЩИЙ, ОПАСНЫЙ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ)
- Полиэтилен
- Воск
- Сахар
- Хлорид цинка (КОРРОЗИОННОЕ, ОПАСНОЕ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ)
- Калий йодид
- Сера (опционально)
Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Всегда используйте защитные очки.
- Свинец, Pb(s), (ТОКСИЧЕСКИЙ) – см. карточку опасности CLEAPSS HC056.
- Медь, Cu(s) – см. карточку опасности CLEAPSS HC026.
- Фенилсалицилат (салол), C 6 H 4 (OH)COOC 6 H 5 (s), (РАЗДРАЖАЮЩЕЕ, ОПАСНОЕ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) – см. карточку опасности CLEAPSS HC052.
- Воск — см. карточку опасности CLEAPSS HC045b.
- Сахар (сахароза), C 12 H 22 O 11 (s) — см. карточку опасности CLEAPSS HC040c.
- Хлорид цинка, ZnCl 2 (s) (КОРРОЗИОННОЕ, ОПАСНОЕ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) – см. карточку опасности CLEAPSS HC108a.
- Йодид калия, KI(s) – см. карточку опасности CLEAPSS HC047b.
- Сера, S 8 (s) – см. карточку опасности CLEAPSS HC096A. Сера является неметаллическим элементом и является хорошим веществом для включения в список. Но есть большая вероятность его возгорания с диоксидом серы, SO 2 (г), (ТОКСИЧЕСКИЙ), выделенный.
Серные пожары трудно потушить. В этом случае накройте сосуд влажной тканью и оставьте на месте до остывания. Если есть время, серу можно сделать в качестве демонстрации учителя. Очень-очень медленно нагревайте небольшой образец «цветов серы». Сера — очень плохой проводник тепла, и локальное нагревание может привести к ее возгоранию! Вы должны использовать вытяжной шкаф.
Процедура
Часть 1
- Настройте цепь, как показано на схеме, на этом этапе не включайте пламя тигля или бунзеновской горелки (о них позже).
Источник: Королевское химическое общество
Прибор, необходимый для определения проводимости различных веществ в твердом и расплавленном состоянии или не он проводит электричество, то выключите ток.
 Опустите электроды так, чтобы они были хорошо погружены в твердое тело, а затем зажмите электроды на месте.
Опустите электроды так, чтобы они были хорошо погружены в твердое тело, а затем зажмите электроды на месте. Часть 2
Повторите шаги с 4 по 10 для некоторых или всех других твердых тел.
Часть 3
Объедините свои результаты с другими группами, чтобы ваша таблица была полной.
Учебные заметки
Ковалентные твердые вещества нужно нагревать только в течение короткого времени, чтобы произошло плавление.
Может оказаться полезным зарезервировать тигель для каждого из порошкообразных соединений, имея при этом один или два других тигля, которые можно нагревать. После того, как твердое вещество было сжижено и ему дали остыть, затвердевший комок часто трудно разбить или превратить в порошок в тигле.
Хлорид цинка плавится примерно при 285 °C, поэтому нагревание должно быть довольно продолжительным по сравнению с ковалентными твердыми веществами. Однако он будет выделять хлор (ТОКСИЧНЫЙ), поэтому нагрев следует прекратить, как только будет обнаружена проводимость. Иодид калия плавится примерно при 675 °С, поэтому здесь необходим очень сильный и продолжительный нагрев.
Вопросы учащихся
- Что вы можете сказать об электропроводности металлов?
- Все ли твердые соединения проводят электричество?
- Любое из расплавленных соединений проводит электричество.
Если да, то какие?
- Почему некоторые вещества проводят ток только в сжиженном состоянии?
- Можете ли вы теперь классифицировать все соединения как ионные или ковалентные?
Ответы
- Все металлы хорошо проводят электричество. Вы должны объяснить эту проводимость с точки зрения «свободных» электронов в металлической структуре.
- Нет, ни один из них.
- Да, хлорид цинка и йодид калия.
- Некоторые вещества являются ионными, но электропроводность возможна только тогда, когда ионы свободны и подвижны. Это происходит после расплавления твердого тела.
- Фенилсалицилат, полиэтилен, воск и сахар являются ковалентными. Хлорид цинка и йодид калия являются ионными.
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов.
© Фонд Наффилда и Королевское химическое общество
Проверка здоровья и безопасности, 2016 г.
11.2: Ионы в растворе (электролиты)
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 49484
- Эд Витц, Джон У. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
- Цифровая библиотека химического образования (ChemEd DL)
- К + и Н + и С 4+ и три О 2–
- K + и H + и CO 3 2–
- K + и HCO 3 –
- Наверх
-
- Была ли эта статья полезной?
-
- Тип изделия
- Раздел или страница
- Автор
- ХимПРАЙМ
- Лицензия
- СС BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
90 035
В книге «Бинарные ионные соединения и их свойства» мы указываем, что когда ионное соединение растворяется в воде, положительные и отрицательные ионы, изначально присутствующие в кристаллической решетке, остаются в растворе.
Вещества, растворы которых проводят электричество, называются электролитами. Все растворимые ионные соединения являются сильными электролитами. Они проводят очень хорошо, потому что они обеспечивают обильный запас ионов в растворе. Некоторые полярные ковалентные соединения также являются сильными электролитами. Типичными примерами являются HCl, HBr, HI и H 2 SO 4 , все из которых реагируют с H 2 O с образованием больших концентраций ионов. Раствор HCl, например, проводит даже лучше, чем раствор NaCl той же концентрации.
Рисунок \(\PageIndex{1}\): Электропроводность растворов электролитов: (а) 0,1 М NaCl (б) 0,05 М NaCl (в) 0,1 М HgCl 2 . Раствор электролита проводит электричество из-за движения ионов в растворе (см.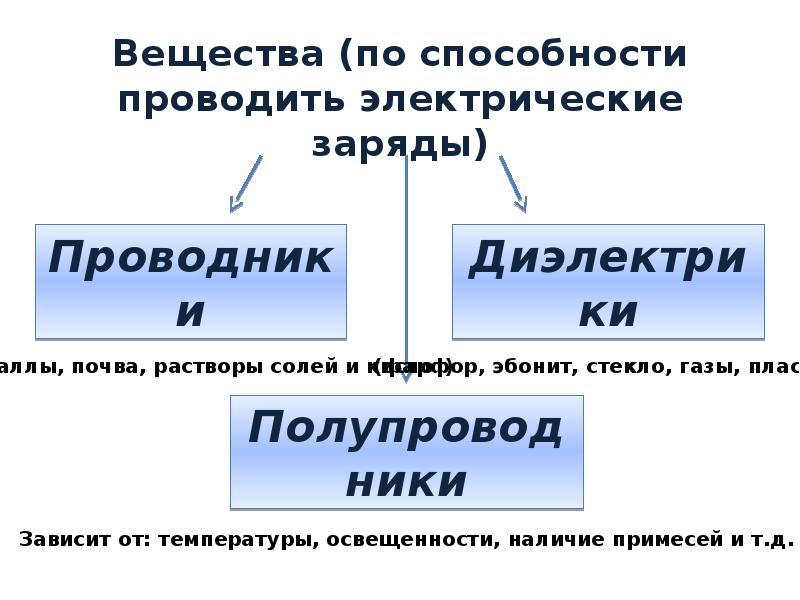
Влияние концентрации ионов на электрический ток, протекающий через раствор, показано на рисунке \(\PageIndex{1}\). Часть и на рисунке показано, что происходит, когда батарея подключается через электросчетчик к двум инертным металлическим полоскам (электроды ), погруженным в этанол. В каждом кубическом дециметре такого раствора содержится 0,10 моль NaCl (то есть 0,10 моль Na + и 0,10 моль Cl – ). Электрический ток через раствор проводят как ионы Na + , движущиеся к отрицательному электроду, так и ионы Cl — , которые притягиваются к положительному электроду. Циферблат на измерителе показывает величину тока.
На рис. 1 b показано, что при замене 0,10- М раствора NaCl на 0,05- М раствора NaCl показание счетчика падает примерно вдвое от прежнего значения.
Измерения проводимости показывают, что большинство ковалентных соединений, если они вообще растворяются в воде, сохраняют свои первоначальные молекулярные структуры. Нейтральные молекулы не могут нести электрические заряды через раствор, поэтому ток не течет. Вещество, водный раствор которого проводит не лучше, чем сама вода, называется неэлектролитом . Некоторые примеры: кислород, O 2 , этанол, C 2 H 5 OH, и сахар, C 12 H 22 O 9.0080 11 .
Рисунок \(\PageIndex{2}\): Кристаллы бромида ртути.
Некоторые ковалентные вещества ведут себя как слабые электролиты — их растворы пропускают только небольшой ток, но он больше, чем у чистого растворителя.
(Двойные стрелки указывают на то, что ионизация протекает лишь в ограниченной степени и достигается равновесное состояние.) Поскольку только 0,2 процента HgCl 2 образует ионы, всего около 0,2% от тока 0,10 M NaCl.
Измерения электропроводности могут сказать нам больше, чем просто о том, является ли вещество сильным, слабым или неэлектролитом. Рассмотрим, например, данные в таблице \(\PageIndex{1}\), в которой показан электрический ток, проводимый через различные водные растворы при одинаковых условиях. При относительно низкой концентрации 0,001 M растворы сильных электролитов проводят в 2500–10 000 раз больше тока, чем чистый H 2 O, и примерно в 10 раз больше, чем слабые электролиты HC 2 H 3 O 2 (уксусная кислота ) и NH 3 (аммиак).
Более внимательное изучение данных для сильных электролитов показывает, что некоторые соединения, содержащие группы H или OH [такие как HCl или Ba(OH) 2 ], проводят необычно хорошо. Если исключить эти соединения, мы обнаружим, что электролиты 1:1 (соединения, состоящие из равного количества ионов +1 и ионов -1) обычно проводят примерно вдвое меньше тока, чем электролиты 2:2 (ионы +2 и -2). Электролиты 1:2 (ионы +1 и -2) или электролиты 2:1 (ионы +2 и -1).
| Вещество | Ток/мА | Вещество | Ток/мА |
|---|---|---|---|
| Чистая вода | 1:2 Электролиты | ||
| Н 2 О | 3,69 x 10 -4 | Na 2 SO 4 | 2,134 |
| Слабые электролиты | Na 2 CO 3 | 2,24 | |
| HC 2 H 3 O 2 | 0,41 | К 2 СО 3 | 2,660 |
| НХ 3 | 0,28 | 2:1 Электролиты | |
| 1:1 Электролиты | MgCl 2 | 2,128 | |
| NaCl | 1,065 | CaCl 2 | 2,239 |
| НаИ | 1,069 | SrCl 2 | 2,290 |
| KCl | 1,273 | BaCl 2 | 2,312 |
| КИ | 1 282 | Ба(ОН) 2 | 4,14 |
| AgNO 3 | 1. 131 131 |
2:2 Электролиты | |
| HCl | 3,77 | MgSO 4 | 2,00 |
| HNO 3 | 3,75 | CaSO 4 | 2,086 |
| NaOH | 2,08 | CuSO 4 | 1,97 |
| КОН | 2,34 | ZnSO 4 | 1,97 |
* Все измерения относятся к cel1, в котором расстояние между электродами составляет 1,0 мм, а площадь каждого электрода составляет 1,0 см².
Этому есть простая причина. В сходных условиях большинство ионов перемещаются в воде с сопоставимыми скоростями. Это означает, что ионы, подобные Mg 2+ или SO 4 2–, которые имеют двойной заряд, будут проводить через раствор вдвое больший ток, чем однозарядные ионы, такие как Na + или Cl – . Следовательно, 0,001 М раствор электролита 2:2, такого как MgSO 4 , будет проводить примерно в два раза лучше, чем 0,001 М раствор электролита 1:1, такого как NaCl.
Аналогичный аргумент применим к растворам электролитов 1:2 и 2:1. Раствор типа 0,001 М NA 2 SO 4 проводит примерно вдвое больше, а 0,001 M NACL частично, потому что в два раза больше NA — , доступных для перемещения, когда аккумулятор связан, но также потому, что так 4 2. – Ионы несут вдвое больший заряд, чем ионы Cl – при движении с той же скоростью.
На основании данных таблицы \(\PageIndex{1}\) можно сделать второй, чуть более тонкий вывод. Когда электролит растворяется, каждый тип ионов вносит независимый вклад в ток, проводимый раствором. В этом можно убедиться, сравнив NaCl с KCl, а NaI с KI. В каждом случае соединение, содержащее K + , проводит примерно на 0,2 мА больше, чем соединение, содержащее Na + . Если применить это наблюдение к Na 2 CO 3 и K 2 CO 3 , каждая из которых образует в растворе в два раза больше ионов Na + или К + , мы находим, что разница в токе также вдвое больше — около 0,4 мА.
Таким образом, измерения электропроводности подтверждают наше утверждение о том, что каждый ион проявляет свои характерные свойства в водных растворах, независимо от присутствия других ионов.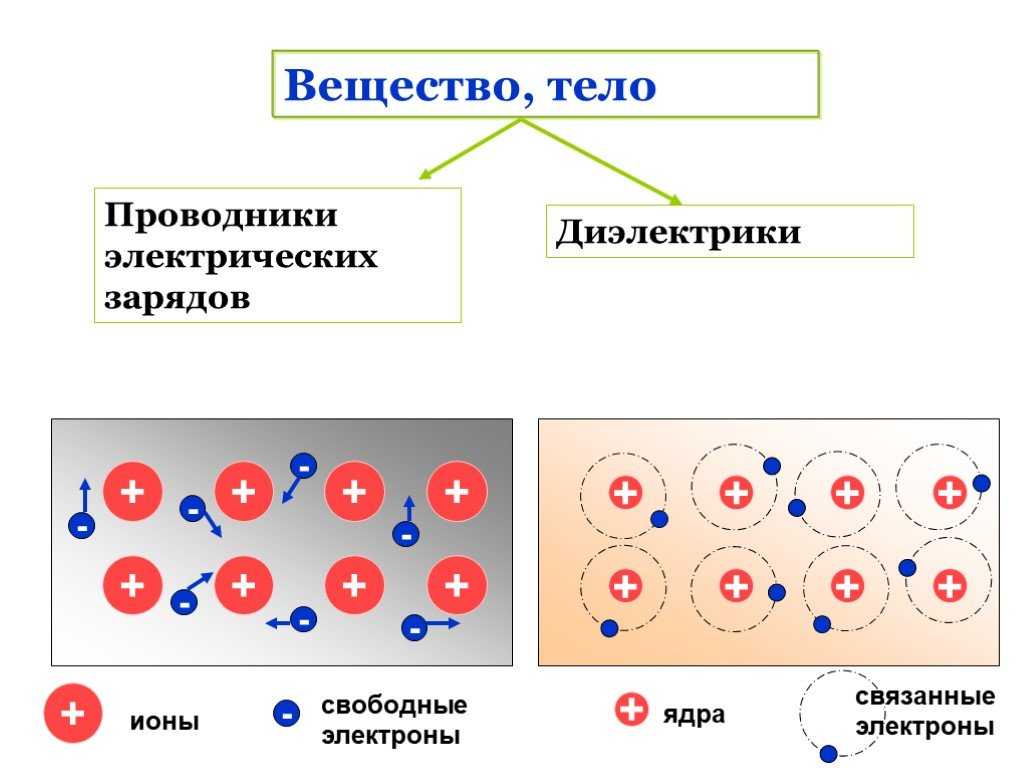
Пример \(\PageIndex{1}\): Ионы
При 18°C 0,001- М водный раствор гидрокарбоната калия, KHCO 3 , проводит ток 1,10 мА в ячейке того же конструкции, использованной для получения данных в таблице 11.1. Какие ионы присутствуют в растворе?
Раствор
Ссылаясь на Таблицу 6.2, в которой перечислены возможные многоатомные ионы, мы можем прийти к трем возможным вариантам ионов, из которых состоит KHCO 3 :
Поскольку ток, проводимый раствором, находится в диапазоне от 1,0 до 1,3 мА, характерном для электролитов 1:1, вариант c является единственным разумным выбором.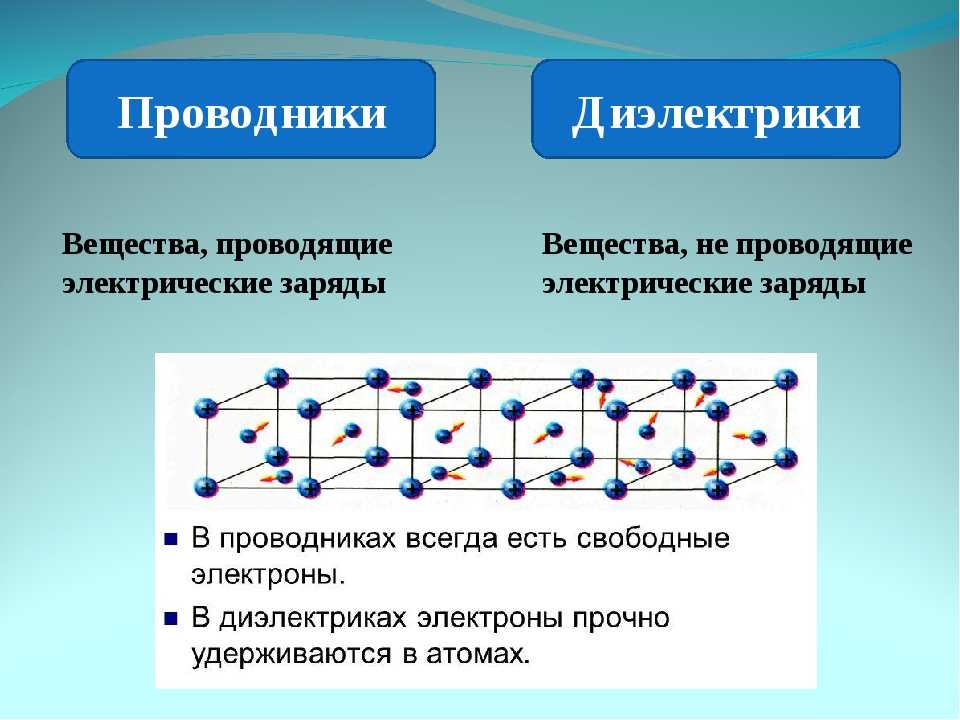
Эта страница под названием 11.2: Ионы в растворе (электролиты) распространяется под лицензией CC BY-NC-SA 4.0, авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавье Прат-Ресина. , Тим Вендорф и Адам Хан.

 Серные пожары трудно потушить. В этом случае накройте сосуд влажной тканью и оставьте на месте до остывания. Если есть время, серу можно сделать в качестве демонстрации учителя. Очень-очень медленно нагревайте небольшой образец «цветов серы». Сера — очень плохой проводник тепла, и локальное нагревание может привести к ее возгоранию! Вы должны использовать вытяжной шкаф.
Серные пожары трудно потушить. В этом случае накройте сосуд влажной тканью и оставьте на месте до остывания. Если есть время, серу можно сделать в качестве демонстрации учителя. Очень-очень медленно нагревайте небольшой образец «цветов серы». Сера — очень плохой проводник тепла, и локальное нагревание может привести к ее возгоранию! Вы должны использовать вытяжной шкаф.  Если да, то какие?
Если да, то какие? 
Добавить комментарий