Содержание
Составьте уравнения анодного и катодного процессов…
Химия11 класс
У
Ученик
Составьте уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары алюминий – железо. Какие продукты коррозии образуются в первом и во втором случаях?
Ирина Сергеевна
Предметы: Подготовка к ЕГЭ, Химия, Подготовка к ОГЭ, Биология
Алюминий имеет более электроотрицательный стандартный электродный потенциал, чем железо, поэтому алюминий является анодом, железо-катодом.
Анодный процесс- окисление металла : AI-3e=AI3+
и катодный процесс- восстановление ионов водорода( водородная деполяризация) или молекул кислорода( кислородная деполяризация). Поэтому при коррозии пары AI-Fe с водородной деполяризацией идут такие процессы:
Анод: AI 0 — 3e=AI3+
Катод(среда кислая): 2H+ +2e= h3 в степени оксиления 0
Продукт коррозии — газообразный водород соединение алюминия и кислотного остатка
Если коррозия этой пары идет в атмосферных условиях на катоде происходит кислородная деполяризация, а на аноде- окисление- железа. 2 – 2, если x > 0,y = 0, если x = 0,y = |x|, если x
Китайский язык7 класс
С
Светлана
В каких случаях в китайском языке применяется притяжательная частица 的。?
Ответ данАнна Юрьевна
Предметы: Китайский язык, Английский язык
Русский язык10 класс
Е
Евгения
Здравствуйте. Разъясните, пожалуйста, что определяет произношение согласного звука?
Ответ данСаният Магомедовна
Предметы: Подготовка к ЕГЭ, Подготовка к ОГЭ, Русский язык
Биология8 класс
Здравствуйте. Изучаем функции головного мозга. Разъясните, пожалуйста, почему мы реагируем на новизну?
Ответ данТатьяна Викторовна
Предметы: Математика, Окружающий мир, Начальные классы, Литературное чтение, Русский язык, Биология
Русский язык7 класс
Н
Настя
Сложно даётся причастие.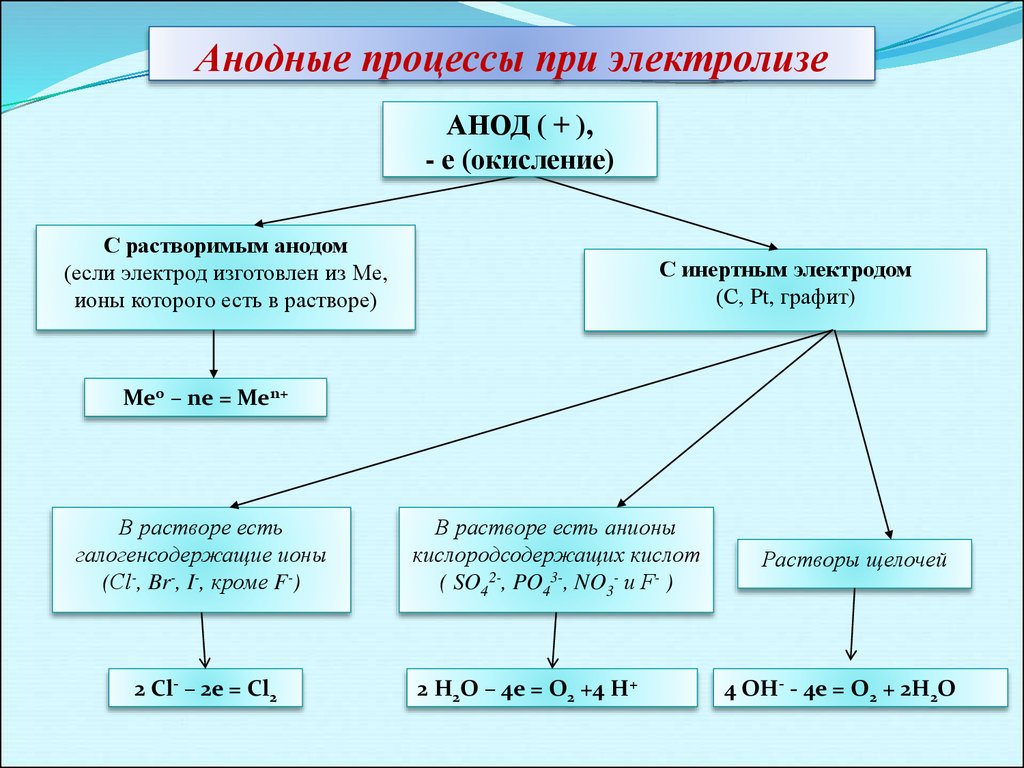
Ответ данИгорь Анатольевич
Предметы: Литература, Русский язык
Математика1 класс
Е
Евгения
Какой знак нужно поставить между цифрами, если нужно найти разность?
Ответ данОксана Владимировна
Предметы: Математика, Подготовка к школе, Окружающий мир, Логопедия, Дефектология, Начальные классы, Литературное чтение, Русский язык
Биология10 класс
Е
Екатерина
Здравствуйте, помогите найти правильный ответ.
Все приведённые ниже утверждения, кроме двух, являются положениями хромосомной теории наследственности. Определите два утверждения, «выпадающих» из общего списка и укажите цифры, под которыми они указаны:
1) признаки родителей наследуются потомками;
2)…
Ответ данЛюдмила Анатольевна
Предметы: Подготовка к ЕГЭ, Химия, Подготовка к ОГЭ, Биология
Математика1 класс
В
Виктория
Решите задачи.
1) В столовую в первую неделю привезли 4 одинаковых мешка крупы, а во вторую – 5 таких же мешков крупы. Всего за две недели привезли 540 кг крупы. Сколько килограммов крупы привозили в каждую неделю?
2) В столовую за две недели привезли 9 одинаковы…
Ответ данОксана Владимировна
Предметы: Математика, Подготовка к школе, Окружающий мир, Логопедия, Дефектология, Начальные классы, Литературное чтение, Русский язык
Геометрия9 класс
Если две стороны и угол одного треугольника равны
соответственно двум сторонам и углу другого треугольника, то такие треугольники
считаются равными?
Ответ данВладислав Владимирович
Предметы: Геометрия, Алгебра, Подготовка к ЕГЭ, Подготовка к ОГЭ
Математика1 класс
Добрый день! Подскажите, какой бывает разрядный состав числа?
Ответ данОксана Владимировна
Предметы: Математика, Подготовка к школе, Окружающий мир, Логопедия, Дефектология, Начальные классы, Литературное чтение, Русский язык
Составить уравнения анодного и катодного процесса h3SO4 Cu(OH)2 — Спрашивалка
Составить уравнения анодного и катодного процесса h3SO4 Cu(OH)2 — Спрашивалка
Оксана
- процесс
- уравнение
Елена Лаврова
Поскольку материал электродов не оговорен, то будем считать, что электролиз проводится при инертных электродах.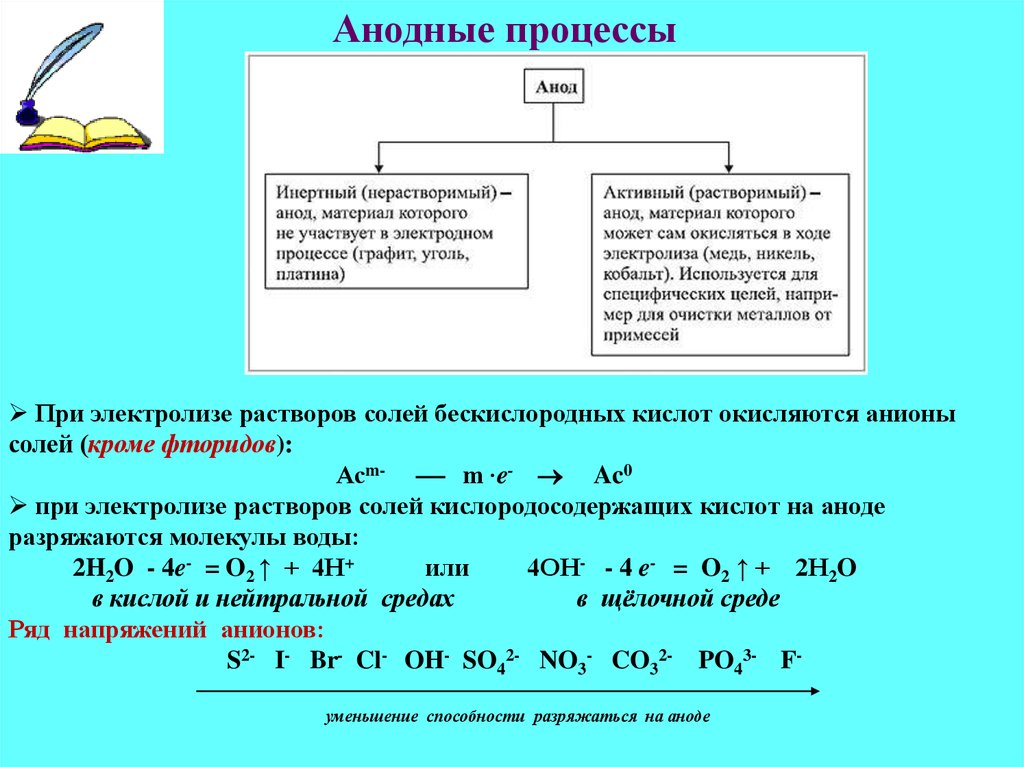
Электролиз раствора h3SO4
Диссоциация h3SO4 в водном растворе
h3SO4 ↔ Н (+) + HSO4(-) (pH
Катодный процесс
На катоде будет протекать электрохимическое восстановление ионов водорода Н (+) (поскольку электролиз протекает в кислой среде) .
Катод (–) 2H(+) + 2e = h3↑(рН
Анодный процесс
На аноде будет протекать электрохимическое окисление воды с выделением кислорода (поскольку электролиз протекает в кислой среде) .
2Н2О – 4е = 4Н (+) + О2↑(рН
Суммарное уравнение электролиза h3SO4 в водном растворе
2Н2О = О2↑ + 2h3↑
Таким образом, в результате электролиза h3SO4 в растворе происходит электролиз воды.
Электролиз раствора Cu(OH)2
Диссоциация Cu(OH)2 в водном растворе.
Cu(OH)2 ↔ CuOH(+) + OH(-) (pH > 7 – среда щелочная)
Гидроксид меди (II) Cu(OH)2 хоть и является нерастворимым в воде основанием, но в незначительной степени диссоциирует на ионы.
Катодный процесс
Поскольку медь в электрохимическом ряду напряжений стоит после водорода, то на катоде будет восстанавливаться медь
Катод (–) Сu(2+) + 2e = Cu↓
Анодный процесс
На аноде будет протекать электрохимическое окисление гидроксид-ионов ОН (-) с выделением кислорода (поскольку электролиз протекает в щелочной среде) .
Анод (+) 4ОН (-) — 4е (-) = О2↑ + 2Н2О (рН > 7 – среда щелочная)
Суммарное уравнение электролиза Cu(OH)2 в водном растворе.
2Cu(OH)2 = Cu↓ + О2↑ + 2Н2О
Похожие вопросы
Химия: Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов???
Осуществить реакции Сu->CuCl2->Cu(OH)2->CuSO4->Cu3(PO4)2 Cu(OH)2->CuO->Cu(NO3)2->Cu
Как составить уравнение получения основной соли из HNO3+Cu(OH)2 И кислой из NaOH+h3SO4?
Составить уравнения анодного и катодного процесса NaClO3 Ca(OH)2
Приведите молекулярные и ионные уравнения возможных реакций: a)AgNo3+Cu(OH)2 b)CO2+Ca(OH)2 в) h3SO4+Fe(OH)2 г) FeCl3+RbOH
Написать уравнения катодного и анодного процессов в ванне цинкования с растворимым цинковым анодом
для гальванического элемента Mn |Mn+2 /|| Ni+2|Ni напишите катодный и анодный процессы, уравнение токообразующей реакц
Составить схему работы гальванического элемента. Напишите уравнения катодного и анодного процесса.
Напишите электронные уравнения анодного и катодного процессов
Помогите, напишите уравнения реакций катодного и анодного процессов!!
20.8: Коррозия — Химия LibreTexts
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21797
Цели обучения
- Понять процесс коррозии.
Коррозия — это гальванический процесс, при котором металлы разрушаются в результате окисления — обычно, но не всегда, до их оксидов. Например, на воздухе железо ржавеет, серебро тускнеет, а медь и латунь приобретают голубовато-зеленую поверхность, называемую патиной.
Коррозия – это окислительно-восстановительный процесс.
В условиях окружающей среды окисление большинства металлов термодинамически самопроизвольно, за заметным исключением золота и платины. Поэтому на самом деле несколько удивительно, что какие-либо металлы вообще полезны во влажной, богатой кислородом атмосфере Земли.
В отличие от этих металлов, железо при коррозии образует красно-коричневый гидратированный оксид металла (\(\ce{Fe2O3 \cdot xh3O}\)), широко известный как ржавчина, который не образует плотной защитной пленки (рис. \(\PageIndex{1}\)). Вместо этого ржавчина постоянно отслаивается, обнажая свежую металлическую поверхность, уязвимую для реакции с кислородом и водой. Поскольку для образования ржавчины необходимы и кислород, и вода, железный гвоздь, погруженный в деоксигенированную воду, не заржавеет даже в течение нескольких недель.
Рисунок \(\PageIndex{1}\): Ржавчина, результат коррозии металлического железа. Железо окисляется до Fe 2 + (водн.) на анодном участке на поверхности железа, который часто является примесью или дефектом решетки. Кислород восстанавливается до воды в другом месте на поверхности железа, которое действует как катод. Электроны переходят от анода к катоду через электропроводящий металл. Вода является растворителем для Fe 2 + , который производится изначально и действует как солевой мостик. Ржавчина (Fe 9o_{cell}\) для процесса коррозии (уравнение \(\ref{Eq3}\)) указывают на то, что существует сильная движущая сила для окисления железа O 2 в стандартных условиях (1 M H + ) . В нейтральных условиях движущая сила несколько меньше, но все же заметна (Е = 1,25 В при рН 7,0).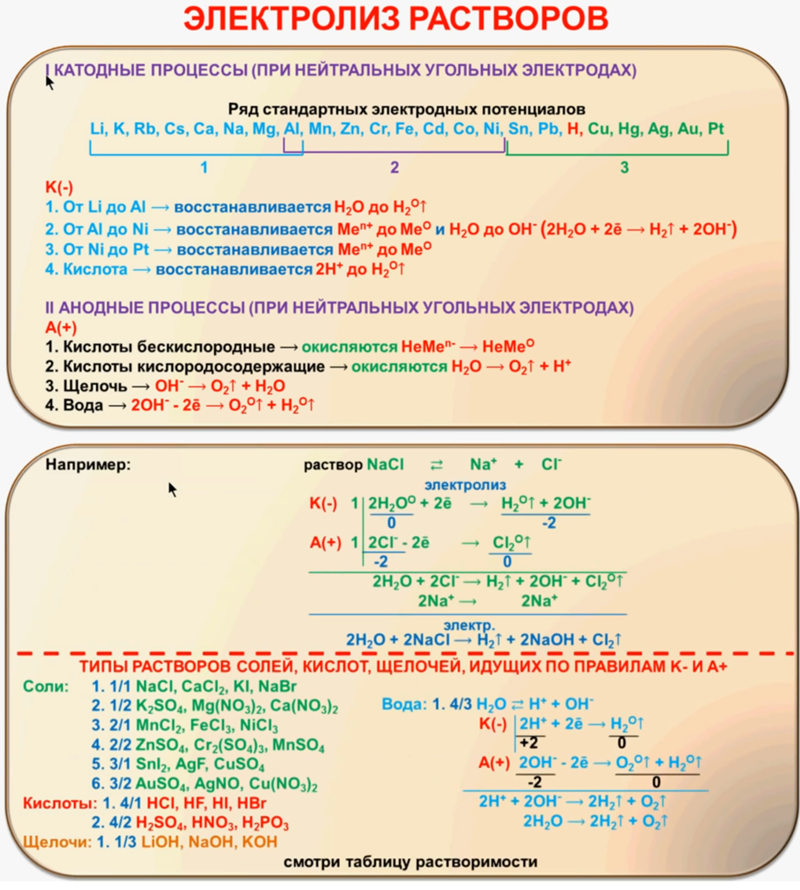
Рисунок \(\PageIndex{2}\): Небольшие царапины на защитном лакокрасочном покрытии могут привести к быстрой коррозии железа. Отверстия в защитном покрытии позволяют восстанавливать кислород на поверхности с большим воздействием воздуха (катод), в то время как металлическое железо окисляется до Fe 2 + (водн.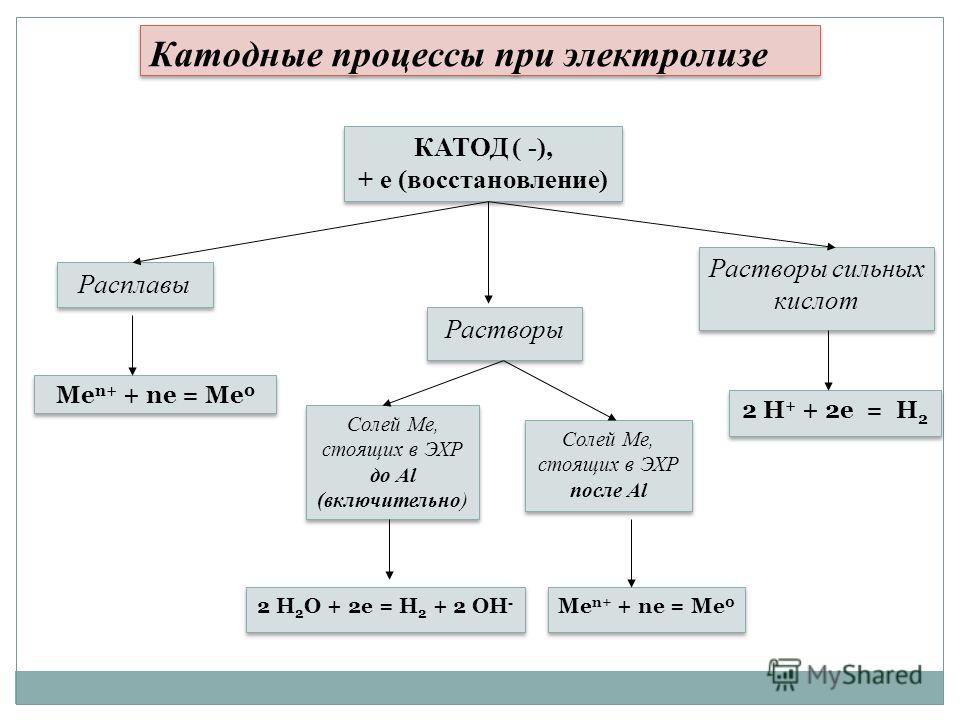
Профилактическая защита
Одним из наиболее распространенных методов предотвращения коррозии железа является нанесение защитного покрытия из другого металла, который труднее окисляется. Например, смесители и некоторые внешние детали автомобилей часто покрывают тонким слоем хрома с помощью электролитического процесса. Однако с увеличением использования полимерных материалов в автомобилях использование хромированной стали в последние годы сократилось. Точно так же «жестяные банки», в которых хранятся супы и другие продукты, на самом деле состоят из стального контейнера, покрытого тонким слоем олова.
Рисунок \(\PageIndex{3}\): Гальваническая коррозия. Если железо находится в контакте с более устойчивым к коррозии металлом, таким как олово, медь или свинец, другой металл может действовать как большой катод, который значительно увеличивает скорость восстановления кислорода. Поскольку восстановление кислорода связано с окислением железа, это может привести к резкому увеличению скорости окисления железа на аноде. Гальваническая коррозия, вероятно, возникает всякий раз, когда два разнородных металла соединяются напрямую, позволяя электронам передаваться от одного к другому. 9{2+}}\) (E° = -0,14 В) и Fe 2 + (E° = -0,45 В) в таблице P2 показывают, что \(\ce{Fe}\) легче окисляется, чем \(\ce{Sn}\). В результате более устойчивый к коррозии металл (в данном случае олово) ускоряет коррозию железа, действуя как катод и обеспечивая большую площадь поверхности для восстановления кислорода (рис.
Более активный металл реагирует с кислородом и в конечном итоге растворяется, «жертвуя» себя, чтобы защитить железный предмет. Катодная защита — это принцип, лежащий в основе оцинкованной стали, которая представляет собой сталь, защищенную тонким слоем цинка. Оцинкованная сталь используется в различных предметах, от гвоздей до мусорных баков.
Кристаллическая поверхность горячеоцинкованной стальной поверхности. Это служило как профилактической защите (защита нижележащей стали от кислорода воздуха), так и катодной защите (после воздействия цинк окисляется раньше, чем нижележащая сталь).
В аналогичной стратегии расходуемые электроды с использованием магния, например, используются для защиты подземных резервуаров или труб (Рисунок \(\PageIndex{4}\)).
Рисунок \(\PageIndex{4}\): Использование жертвенного электрода для защиты от коррозии. Присоединение магниевого стержня к подземному стальному трубопроводу защищает трубопровод от коррозии. Поскольку магний (E ° = -2,37 В) окисляется гораздо легче, чем железо (E ° = -0,45 В), стержень Mg действует как анод в гальваническом элементе. Таким образом, трубопровод вынужден действовать как катод, на котором восстанавливается кислород. Почва между анодом и катодом действует как солевой мост, который замыкает электрическую цепь и поддерживает электрическую нейтральность. Поскольку Mg(s) окисляется до Mg 2 + на аноде, анионы в почве, такие как нитраты, диффундируют к аноду, чтобы нейтрализовать положительный заряд. Одновременно катионы в почве, такие как H + или NH 4 + , диффундируют к катоду, где они восполняют протоны, потребляемые при восстановлении кислорода.
Пример \(\PageIndex{1}\)
Предположим, старый деревянный парусник, скрепленный железными винтами, имеет бронзовый гребной винт (напомним, что бронза — это сплав меди, содержащий около 7–10 % олова). 9\circ_{\textrm{overall}} =\textrm{1,68 В}
\end{align*} \nonumber \]
Со временем железные винты растворятся, и лодка развалится.
- B Возможные способы предотвращения коррозии, в порядке снижения затрат и неудобств, следующие: разборка лодки и ее сборка с помощью бронзовых винтов; снятие лодки с воды и хранение ее в сухом месте; или прикрепление недорогого куска металлического цинка к гребному валу в качестве жертвенного электрода и замена его один или два раза в год. Поскольку цинк является более активным металлом, чем железо, он будет действовать как расходуемый анод в электрохимической ячейке и растворяться (уравнение \(\ref{Eq7}\)).
Цинковый расходуемый анод (округлый предмет, привинченный к нижней части корпуса), используемый для предотвращения коррозии винта в лодке посредством катодной защиты. Изображение Реми Каупп и используется с разрешения.
Упражнение \(\PageIndex{1}\)
Предположим, что водопроводные трубы, ведущие в ваш дом, сделаны из свинца, а остальная сантехника в вашем доме — из железа. Чтобы исключить возможность отравления свинцом, вы вызываете сантехника для замены свинцовых труб. Он назовет вам очень низкую цену, если он сможет использовать свой существующий запас медных труб для выполнения этой работы.
- Вы принимаете его предложение?
- Что еще нужно сделать сантехнику в вашем доме?
- Ответить на
-
Нет, если только вы не планируете продать дом в ближайшее время, потому что соединения труб \(\ce{Cu/Fe}\) приведут к быстрой коррозии.
- Ответ б
-
Любые существующие соединения \(\ce{Pb/Fe}\) должны быть тщательно проверены на наличие коррозии железных труб из-за соединения \(\ce{Pb–Fe}\); менее активный \(\ce{Pb}\) будет служить катодом для восстановления \(\ce{O2}\), способствуя окислению более активного \(\ce{Fe}\) поблизости.
Резюме
Коррозия — это гальванический процесс, который можно предотвратить с помощью катодной защиты. Ухудшение металлов в результате окисления представляет собой гальванический процесс, называемый коррозией. Защитные покрытия состоят из второго металла, который труднее окисляется, чем защищаемый металл. В качестве альтернативы на металлическую поверхность можно нанести более легко окисляющийся металл, что обеспечит катодную защиту поверхности. Тонкий слой цинка защищает оцинкованную сталь. Жертвенные электроды также могут быть прикреплены к объекту для его защиты.
20.8: Коррозия распространяется под лицензией CC BY-NC-SA 3.0 и была создана, изменена и/или курирована LibreTexts.
- Наверх
-
- Была ли эта статья полезной?
-
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.
-
- Теги
-
- коррозия
- Профилактическая защита
- протекторный анод
- жертвенный электрод
Коррозия — электрохимическая4
Коррозия — электрохимическая4
| Коррозия и ухудшение состояния окружающей среды |
|
||||||||||||||
| ·
коррозия цинка в электролите, насыщенном кислородом соляной кислоты, иллюстрирует Zn -> Zn 2+ 2H + О 2 от Метки: Комментарии | |||||||||||||||





Добавить комментарий