Содержание
Тренажер задания 31 по химии меди
Тренажер задания 31 из ЕГЭ по химии меди, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии меди с текстовыми решениями и ответами.
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок. Напишите уравнения описанных реакций.
9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты.
Понравилось это:
Нравится Загрузка…
Овр с медью и его соединениями. химия егэ
ОВР С МЕДЬЮ
И ЕГО СОЕДИНЕНИЯМИ.
ХИМИЯ ЕГЭ
Строение атома меди
+29 Сu)2)8)18)1;
Ожидаемая электронная формула
1s2 2s2 2p6 3s2 3p6 4s2 3d9
Но мы наблюдаем проскок: один электрон s-подуровня переходит на d-подуровень для того, чтобы положение было устойчивым.
1s22s22p63s23p63d104s1.
Краткая запись: [Ar] 3d104s1
Медь и соединения меди
СuSO4 + 4NН3 = [Cu(NH3)4] SO4
CuSO4 + 2NH3 +2H2O = Cu(OH)2 + (NH4)2SO4
CuCl2 + 4NH3 = [Cu(NH3)4]Cl2
Гидроксид меди (II) легко взаимодействует с раствором аммиака, образуя сине-фиолетовое комплексное соединение:
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
Cu(OH)2 + 4NH3 * H2O = [Cu(NH3)4](OH)2 + 4H2O (при условии, если взят раствор аммиака)
CuO + 4Nh4 + H2O → [Cu(Nh4)4](OH)2 ·
CuO + 4(Nh4•H2O) → [Cu(Nh4)4](OH)2 + 3H2O
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH
CuCl + 2NH3 = [Cu(NH3)2]Cl
CuCl + 3NH3 + H2O → [Cu(NH3)2]OH + NH4Cl
Аg2O + 4NH3 + H2O = 2[Ag(NH3)2]OH
AgCl + 2NH
3 ⇄ [Ag(NH3)2]Cl
AgCl + 2NH3 + H2O = [Ag(NH3)2]OH + HCl.
Медь взаимодействует с галогенами. При этом образуются галогениды меди (II): Но с иодом образует иодид меди(I):
2Cu + I2 = 2CuI
С азотом, углеродом и кремнием медь не реагирует:
Cu + N2 ≠
Cu + C ≠
Cu + Si ≠
Медь не взаимодействует с водородом.
4Cu + SO
2 Cu2S + 2CuO
2Cu + 2NO = 2CuO + N2↑.
4Cu + 2NO2 = 4CuO + N2↑.
Медь и соединения меди
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок. Напишите уравнения описанных реакций.
9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора.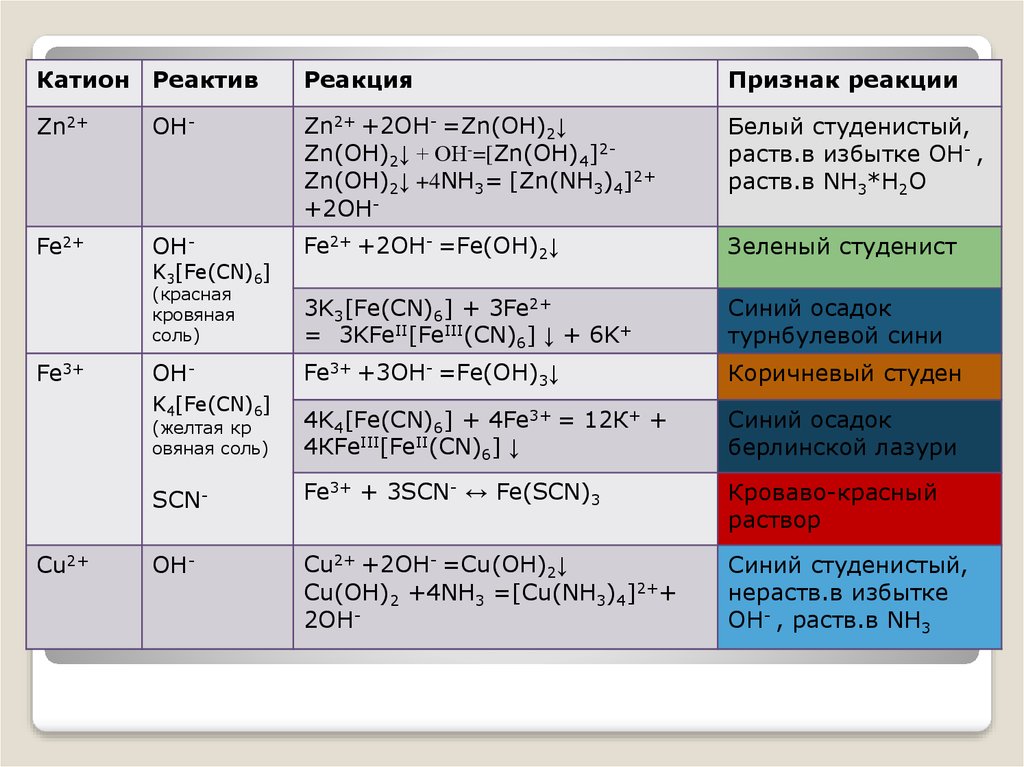
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.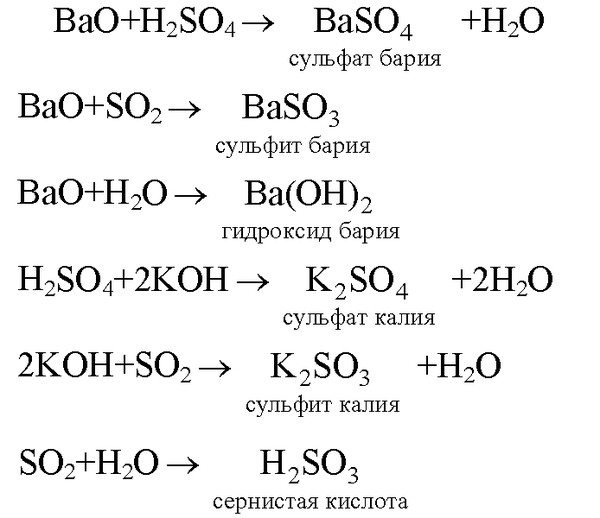
Ответы и решения
1.CuCl2 Cu + Сl2
на катоде на аноде
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 =2CuO + 4NO2↑ + O2↑
6NaOH(гор.) + 3Cl2 = NaClO3 + 5NaCl + 3H2O
2.CuCl2 = Cu + Сl2
на катоде на аноде
Cu + S = CuS
CuS + 8HNO3(конц.гор.) = CuSO4 + 8NO2↑ + 4H2O
или CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
3.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
2NaNO3 = 2NaNO2 + O2↑
4.Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
CuO + 2HNO3 = Cu(NO3)2 + H2O
5. 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
Cu(NO3)2 + 2КOH = Cu(OH)2↓ + 2КNO3
Cu(OH)2 = CuO + H2O
CuO + C Cu + CO
6.
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 5H2SO4 = CuSO4 + 4NH4HSO4 + 2H2O
7. Cu2O + 6HNO3(конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
8. (CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + H2 = Cu + H2O
Cu + 2H2SO4(конц.
CuSO4 + Cu + 2NaCl = 2CuCl↓ + Na2SO4
9.3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
на катоде на аноде
2Na + O2 = Na2O2
2Na2O2 + CO2 = 2Na2CO3 + O2
10.(CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
3CuO + 2NH3 = 3Cu + N2 + 3H2O
11.
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 = CuO + H2O
CuO + H2 = Cu + H2O
12.Cu + Cl2 = CuCl2
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Cu(OH)2 = CuO + H2O
CuO + C = Cu + CO
13.Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
CuO + H2 = Cu + H2O
14. 2Cu + O2 = 2CuO
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + NaOH = Cu(OH)2↓ + Na2SO4
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
15.
Cu(OH)2 = CuO + H2O
CuO + C = Cu + CO
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
16. 2Cu + I2 = 2CuI
2CuI + 4H2SO4 = 2CuSO4 + I2 + 2SO2 + 4H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 = CuO + H2O
17. 2CuCl2 + 2Na2CO3 + H2O = (CuOH)2CO3 + CO2 + 4NaCl
(CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + H2 = Cu + H2O
3Cu + 8HNO3(разб.
18. 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 3H2SO4 = CuSO4 + 2(NH4)2SO4 + 2H2O
19) Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 6HCl = CuCl2 + 4NH4Cl + 2H2O
20.
CuO + H2 = Cu + H2O
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
21. I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
4NO2 + 2H2O + O2 = 4HNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
22. Cu2O + 3H2SO4 = 2CuSO4 + SO2 + 3H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 = CuO + H2O
3CuO + 2NH3 = 3Cu + N2 + 3H2O
23.
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
24. CuO + CO = Cu + CO2
Cu + Cl2 = CuCl2
2CuCl2 + 2KI = 2CuCl↓ + I2 + 2KCl
CuCl2 + 2AgNO3 = 2AgCl↓ + Cu(NO3)2
.25. 2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
CuO + H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
Cu + 4HNO3(конц.
26. H2C2O4 = CO↑ + CO2↑ + H2O
CO2 + Ca(OH)2 = CaCO3 + H2O
2Cu(NO3)2 =2CuO + 4NO2↑ + O2↑
CuO + CO = Cu + CO2
27. Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
SO2 + 2KOH = K2SO3 + H2O
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Правила растворимости — Химия LibreTexts
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 238
При смешивании вещества с растворителем возможно несколько результатов.
Влияние растворимости на реакции
В зависимости от растворимости растворенного вещества возможны три результата: 1) если в растворе меньше растворенного вещества, чем максимальное количество, которое оно способно растворить (его растворимость), то это разбавленный раствор; 2) если количество растворенного вещества точно равно его растворимости, то оно насыщено; 3) если растворенного вещества больше, чем оно может быть растворено, избыток растворенного вещества отделяется от раствора. Если этот процесс разделения включает кристаллизацию, то образуется осадок. Осаждение снижает концентрацию растворенного вещества до насыщения, чтобы повысить стабильность раствора.
Правила растворимости
Ниже приведены правила растворимости для обычных ионных твердых веществ.
- Соли, содержащие элементы I группы (Li + , Na + , K + , Cs + , Rb + ), растворимы. Есть несколько исключений из этого правила. Соли, содержащие ион аммония (NH 4 + ), также растворимы.
- Соли, содержащие нитрат-ион (NO 3 — ) обычно растворимы.
- Соли, содержащие Cl —, Br — или I —, обычно растворимы. Важными исключениями из этого правила являются галоидные соли Ag + , Pb 2 + и (Hg 2 ) 2+ . Так, AgCl, PbBr 2 и Hg 2 Cl 2 нерастворимы.
- Большинство солей серебра нерастворимы. AgNO 3 и Ag(C 2 H 3 O 2 ) – обычные растворимые соли серебра; практически все остальные нерастворимы.
- Большинство сульфатных солей растворимы. Важные исключения из этого правила включают CaSO 4 , BaSO 4 , PbSO 4 , Ag 2 SO 4 и SrSO 4 .
- Большинство гидроксидных солей мало растворимы. Гидроксидные соли элементов I группы растворимы. Гидроксидные соли элементов II группы (Ca, Sr, Ba) малорастворимы. Гидроксидные соли переходных металлов и Al 3 + нерастворимы. Так, Fe(OH) 3 , Al(OH) 3 , Co(OH) 2 не растворимы.
- Большинство сульфидов переходных металлов плохо растворимы, включая CdS, FeS, ZnS и Ag 2 S. Нерастворимы также сульфиды мышьяка, сурьмы, висмута и свинца.
- Карбонаты часто нерастворимы. Карбонаты группы II (CaCO 3 , SrCO 3 и BaCO 3 ) нерастворимы, как и FeCO 3 9.0046 и PbCO 3 .
- Хроматы часто нерастворимы.
Примеры включают PbCrO 4 и BaCrO 4 .
- Фосфаты, такие как Ca 3 (PO 4 ) 2 и Ag 3 PO 4 , часто нерастворимы.
- Фториды, такие как BaF 2 , MgF 2 и PbF 2 , часто нерастворимы.
{{media(«www.youtube.com/watch?v=VJoKQ3ULCVs&NR=1»)}}
Ссылки
- Петруччи, Ральф Х., Ф. Джеффри Херринг, Джеффри Д. Мадура и Кэри Биссоннетт. Общая химия: принципы и современные приложения. 10-е изд. Река Аппер-Сэдл, Нью-Джерси: Pearson Education, 2011. Печать.
- Натан, Гарольд Д. и Чарльз Хенриксон. Химия . Нью-Йорк: Wiley, 2001. Печать.
Проблемы
1. Растворим ли FeCO 3 ?
Согласно правилу №5 карбонаты обычно нерастворимы. Следовательно, FeCO 3 может образовывать осадок .
2. Имеет ли ClO 4 — тенденцию к образованию осадка?
Это перхлорат, который, согласно правилу №2, вероятно, растворим.
3. Какое из этих веществ может образовывать осадок?
a) CaSO 4 b) поваренная соль c) AgBr
Буквы a и c могут образовывать осадки .
Относительно a) CaSO 4 , хотя сульфаты, как правило, растворимы, Правило № 5 указывает, что сульфат кальция является важным исключением из этого правила.
Для b) Правило № 1 указывает, что поваренная соль (NaCl) растворима, поскольку она является солью щелочного металла.
c) является примером двух правил, противоречащих друг другу. Правило № 4 гласит, что бромиды обычно растворимы, а Правило № 3 гласит, что соли серебра нерастворимы. Поскольку правило № 3 предшествует правилу № 4, соединение нерастворимо и образует осадок.
4. Предскажите, будет ли образовываться осадок в результате этой реакции:
\[2AgNO_3 + Na_2S \rightarrow Ag_2S + 2NaNO_3 \]
Необходимо исследовать продукты реакции; если одно из образовавшихся в реакции веществ нерастворимо, выпадет осадок.
Принимая во внимание NaNO 3 , Правило № 3 гласит, что нитраты обычно растворимы. Осадок этого соединения не образуется.
Далее рассмотрим Ag 2 S. Согласно Правилу №5, эти сульфиды имеют тенденцию быть нерастворимыми. Поэтому из-за этого соединения в ходе этой реакции образуется осадок .
5. Предскажите, образуется ли в результате этой реакции осадок:
\[2NaOH + K_2CrO_4 \rightarrow KOH + Na_2CrO_4 \]
Еще раз рассмотрим продукты реакции: если один из них нерастворим, то образуется осадок .
Первый продукт, KOH, является примером двух противоречащих друг другу правил. Хотя Правило № 5 говорит, что гидроксиды, как правило, нерастворимы, Правило № 1 утверждает, что соли катионов щелочных металлов имеют тенденцию быть растворимыми, а Правило № 1 предшествует Правилу № 5. Следовательно, это соединение не будет способствовать образованию каких-либо осадков.
Второй продукт, Na 2 CrO 4 , также соответствует правилу № 1, которое гласит, что соли щелочных металлов имеют тенденцию быть растворимыми.
Поскольку оба продукта растворимы, в результате этой реакции не образуется осадок.
Solubility Rules распространяется под лицензией CC BY 4.0, автором, ремиксом и/или куратором выступили Антуанетта Мурса и Кеннет В. Буш.
- Наверх
-
- Была ли эта статья полезной?
-
- Тип изделия
- Раздел или Страница
- Лицензия
- СС BY
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
-
- Теги
-
- автор @ Антуанетта Мурса
- автор@Кеннет В.
Буш
- правила растворимости
|
РЕАКЦИИ ИОНОВ МЕТАЛЛА HEXAAQUA С РАСТВОРОМ АММИАКА На этой странице описаны и объяснены реакции между комплексными ионами типа [M(H 2 O) 6 ] n+ и раствор аммиака. |
||
|
Важно: Прежде чем читать эту страницу, вам необходимо узнать о кислотности ионов гексааква. Было бы также полезно прочитать еще две страницы: одну с описанием реакций этих ионов с гидроксид-ионами и одну с объяснением реакций лигандного обмена. Данная страница содержит информацию со всех этих страниц, и вам будет легче ее понять, если вы сначала потратите некоторое время на чтение этих других страниц. Наверное, проще всего будет вернуться на эту страницу через меню сложных ионов.
|
||
|
Реакции гексааква ионов с раствором аммиака осложняются тем, что аммиак может выполнять две совершенно разные функции. Он может действовать как основание (в смысле Бренстеда-Лоури), но также является возможным лигандом, который может замещать молекулы воды вокруг центрального иона металла. Когда он действует как лиганд, он действует как основание Льюиса. Нам нужно рассмотреть эти две функции отдельно. |
||
|
Примечание: Если вы не знакомы ни с одним из этих терминов, перейдите по этой ссылке на страницу, посвященную теориям кислот и оснований. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу, если вы уверены в этих условиях.
|
||
|
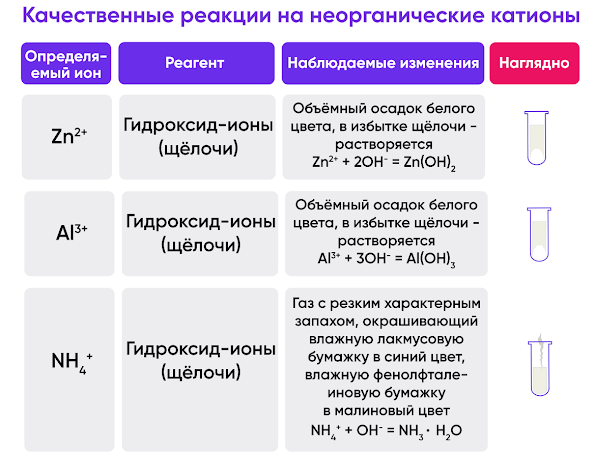
Аммиак, действующий как основание (Бренстеда-Лоури) Общий случай Вот что происходит, когда вы добавляете только небольшое количество разбавленного раствора аммиака к любому из ионов гексааква. Мы поговорим о том, что произойдет, если вы добавите небольшое количество разбавленного раствора аммиака к раствору, содержащему ион гексааква 2+. Они имеют формулу [M(H 2 O) 6 ] 2+ , и они кислые. Их кислотность проявляется в реакции ионов гексааква с молекулами воды из раствора: Они действуют как кислоты, отдавая ионы водорода молекулам воды в растворе. Из-за сбивающего с толку присутствия воды из двух разных источников (лиганды и раствор) это проще упростить: Добавление раствора аммиака к этому равновесию – стадия 1 Возможны две реакции. Реакция аммиака с ионами гидроксония (ионами водорода) Аммиак будет реагировать с ними с образованием ионов аммония. В соответствии с принципом Ле Шателье положение равновесия сдвинется вправо, производя больше нового комплексного иона.
|
||
|
Примечание: Вам действительно необходимо знать о принципе Ле Шателье, особенно в отношении влияния изменений концентрации на положение равновесия. Перейдите по этой ссылке, если вы не уверены. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу.
|
||
|
Реакция аммиака с гексаакваионом Статистически вероятность того, что молекула аммиака столкнется с ионом гексааква металла, гораздо выше, чем с ионом водорода. Присутствует гораздо больше гексааква ионов. Если это произойдет, вы получите точно такой же новый комплексный ион, как и выше. Обратите внимание, что это по-прежнему обратимое изменение (в отличие от соответствующего изменения при добавлении ионов гидроксида). Аммиак — всего лишь слабое основание. Вторая стадия реакции Какая бы из приведенных выше реакций ни произошла, в итоге вы получите [M(H 2 O) 5 (OH)] + ионов в растворе. Берем более легкую версию равновесия: Добавление аммиака снова сдвигает равновесие вправо — либо за счет реакции с ионами водорода, либо за счет прямой реакции с комплексом в левой части. Когда это происходит, новый образовавшийся комплекс уже не имеет заряда — это «нейтральный комплекс». Он нерастворим в воде — поэтому образуется осадок. Этот осадок часто записывают без учета оставшихся водных лигандов. Другими словами, мы записываем это как M(OH) 2 . Образовался осадок гидроксида металла. Подведение итогов
Вы также можете записать полное изменение в виде общей равновесной реакции. Это будет важно для дальнейшего. Если бы вы проделали ту же реакцию с ионом 3+, с той лишь разницей, что вам пришлось бы удалить в общей сложности 3 иона водорода, чтобы получить нейтральный комплекс. Изучение ионов определенных металлов Помните, что сейчас мы концентрируемся на аммиаке, действующем как основание, другими словами, на образовании осадка гидроксида при добавлении небольшого количества раствора аммиака к растворам, содержащим ионы гексааква металла. Однако на диаграммах будет показано полное изменение, поэтому мне не придется повторять их позже. Случаи, когда осадок временно растворяется в избытке аммиака, не учитывать. 2+ ионов гексааквакобальт(II)
|
||
|
Примечание: Конечный раствор быстро темнеет на воздухе до темно-красно-коричневого цвета. Это связано с окислением гексаамминкобальта (II) в ионы гексаамминкобальта (III). Более подробно это окисление описано на странице о химии кобальта. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу.
|
||
|
гексааквамедь(II)
гексаакварон(II)
Железо очень легко окисляется в щелочной среде. Кислород в воздухе окисляет осадок гидроксида железа (II) до гидроксида железа (III), особенно в верхней части пробирки. Потемнение осадка происходит от того же эффекта. Это НЕ реакция обмена лиганда. гексааквамарганец(II)
Я показал исходный раствор очень бледно-розовым (наиболее бледно-розовым, что я могу сделать!), но на самом деле он практически бесцветен. Бледно-коричневый осадок окисляется до более темно-коричневого соединения марганца (III) при контакте с кислородом воздуха. Опять же, это не реакция обмена лигандами. |
||
|
Примечание: В литературе существует много разногласий по поводу того, что представляет собой соединение более темного коричневого цвета. Однако в некоторых источниках он упоминается как гидратированный оксид марганца (IV), MnO 2 ,xH 2 O. Одна из экзаменационных комиссий Великобритании (Edexcel International) задала этот вопрос в январе 2015 года. Если ваши экзаменаторы могут спросить вас об этом, вы должны проверить, что именно они ожидают от вас в вашем ответе. Проверьте прошлые работы, отметьте схемы и отчеты экзаменатора.
|
||
|
гексаакваникель(II)
гексааквацинк
Вы начинаете и заканчиваете с бесцветными растворами, по пути образуя белый осадок. |
||
|
Примечание: Я показал конечный ион цинка как [Zn(NH 3 ) 4 ] 2+ , но я не уверен в этом.
|
||
|
3+ иона гексаакваалюминий
Начиная с бесцветного раствора, вы получаете белый осадок. гексааквахром(III)
гексаакварон(III)
Краткое описание эффекта добавления небольшого количества раствора аммиака В каждом случае получается осадок нейтрального комплекса — гидроксида металла. Если не считать незначительных различий в точном оттенке цвета, которые вы получаете, они почти все точно такие же, как осадки, которые вы получаете, когда вы добавляете немного раствора гидроксида натрия к растворам ионов гексааква. Единственная реальная разница заключается в цвете осадка кобальта. Аммиак, действующий как лиганд Реакция лигандного обмена В некоторых случаях аммиак замещает воду вокруг центрального иона металла, образуя другой растворимый комплекс. Это известно как реакция обмена лигандами и включает в себя равновесие, подобное этому: Образование этого нового растворимого комплекса вызывает растворение осадка. Аммиак присоединяется к центральному иону металла с помощью неподеленной пары электронов на атоме азота. Поскольку это донор неподеленной пары, он действует как основание Льюиса. Объяснение того, почему осадок растворяется Почти все учебники оставляют аргументацию на этом месте, полагая, что очевидно, почему образование комплекса вызывает растворение некоторых осадков. Это не так! Если вы хотите узнать довольно сложные причины, читайте дальше. . . Типичным для любого из них возьмем медный корпус. Здесь задействованы два равновесия. Другой — реакция обмена лиганда: Обратите внимание, что в обоих случаях присутствует гексаакваион. Теперь есть взаимодействие между двумя равновесиями:
Глядя на это таким образом, можно понять, почему одни осадки растворяются в избытке аммиака, а другие нет. Это зависит от положения равновесий. Чтобы заставить осадок раствориться, вам, очевидно, нужно, чтобы равновесие обмена лигандов лежало вправо, но вам нужно, чтобы кислотно-щелочное равновесие можно было легко отодвинуть влево.
| ||

 Примеры включают PbCrO 4 и BaCrO 4 .
Примеры включают PbCrO 4 и BaCrO 4 .  Буш
Буш 
 Эффект лиганда бывает только при избытке аммиака или при концентрированном аммиаке, а у некоторых металлов его и не видно.
Эффект лиганда бывает только при избытке аммиака или при концентрированном аммиаке, а у некоторых металлов его и не видно. 
 Они также кислые и могут терять ионы водорода из другого водного лиганда.
Они также кислые и могут терять ионы водорода из другого водного лиганда.  Это дало бы общее уравнение:
Это дало бы общее уравнение: 
 Чаще всего цитируется (в том числе в паре исследовательских работ) как MnO(OH) или иногда как Mn9.0045 2 О 3 ,xH 2 О.
Чаще всего цитируется (в том числе в паре исследовательских работ) как MnO(OH) или иногда как Mn9.0045 2 О 3 ,xH 2 О. Некоторые источники (хотя и меньшинство) показывают его как [Zn(NH 3 ) 4 (H 2 О) 2 ] 2+ . Я не знаю, что правильно!
Некоторые источники (хотя и меньшинство) показывают его как [Zn(NH 3 ) 4 (H 2 О) 2 ] 2+ . Я не знаю, что правильно! 
 Первый — это тот, в котором аммиак действует как основание и дает осадок:
Первый — это тот, в котором аммиак действует как основание и дает осадок: 
Добавить комментарий