|
|
Тренажер задания 31 по химии азота
Тренажер задания 31 из ЕГЭ по химии азота, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии азота с текстовыми решениями и ответами.
- Две соли содержат одинаковый катион. Термический распад первой из них напоминает извержение вулкана, при этом выделяется малоактивный бесцветный газ, входящий в состав атмосферы. При взаимодействии второй соли с раствором нитрата серебра образуется белый творожистый осадок, а при нагревании её с раствором щелочи выделяется бесцветный ядовитый газ с резким запахом; этот газ может быть получен также при взаимодействии нитрида магния с водой. Напишите уравнения описанных реакций.
- Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрасился в бурый цвет, который исчезал через некоторое время. Полученный раствор осторожно выпарили и установили, что твёрдый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остается единственное вещество. Напишите уравнения описанных реакций.
- В результате термического разложения дихромата аммония получили газ, который пропустили над нагретым магнием.
Образовавшееся вещество поместили в воду. образовавшийся при этом газ пропустили через свежеосажденный гидроксид меди (II). Напишите уравнения описанных реакций.
- Газ, выделившийся на аноде при электролизе нитрата ртути (II), был использован для каталитического окисления аммиака. Получившийся в результате реакции бесцветный газ мгновенно вступил в реакцию с кислородом воздуха. Образовавшийся бурый газ пропустили через баритовую воду. Напишите уравнения описанных реакций.
- Йод поместили в пробирку с концентрированной горячей азотной кислотой. выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
- Продукт взаимодействия лития с азотом обработали водой.
Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали хлоридом бария. Раствор профильтровали, а фильтрат смешали с раствором нитрита натрия и нагрели. Напишите уравнения описанных реакций.
- Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделилось простое вещество. К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили, фильтрат упарили, полученный твердый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь. Напишите уравнения описанных реакций.
- Две соли содержат одинаковый катион. Термический распад первой из них напоминает извержение вулкана, при этом выделяется малоактивный бесцветный газ, входящий в состав атмосферы. При взаимодействии второй соли с раствором нитрата серебра образуется белый творожистый осадок, а при нагревании ее с раствором щелочи выделяется бесцветный ядовитый газ с резким запахом; этот газ может быть получен также при взаимодействии нитрида магния с водой.
Напишите уравнения описанных реакций.
- Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрашивался в бурый цвет, который исчезал через некоторое время. Полученный раствор осторожно выпарили и установили, что твердый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остается единственное вещество. Напишите уравнения описанных реакций.
- Смесь двух бесцветных, не имеющих цвета и запаха, газов А и Б пропустили при нагревании над катализатором, содержащим железо, и образующимся при этом газом В нейтрализовали раствором бромоводородной кислоты. Раствор выпарили и остаток нагрели с едким кали, в результате выделился бесцветный газ В с резким запахом. При сжигании газа В на воздухе образуется вода и газ А. Напишите уравнения описанных реакций.
- Азотную кислоту нейтрализовали пищевой содой, нейтральный раствор осторожно выпарили и остаток прокалили.
Образовавшееся вещество внесли в подкисленный серной кислотой раствор перманганатом калия, при этом раствор обесцветился. Азотсодержащий продукт реакции поместили в раствор едкого натра и добавили цинковую пыль, при этом выделился газ с резким характерным запахом. Напишите уравнения описанных реакций.
- Азотоводородную смесь нагрели до температуры 500º С и под высоким давлением пропустили над железным катализатором. Продукты реакции пропустили через раствор азотной кислоты до его нейтрализации. Образовавшийся раствор осторожно выпарили, твердый остаток прокалили и выделившийся при этом газ пропустили над медью при нагревании, в результате образовалось вещество черного цвета. Напишите уравнения описанных реакций.
- Продукт взаимодействия азота и лития обработали водой. Выделившийся в результате реакции газ смешали с избытком кислорода и при нагревании пропустили над платиновым катализатором; образовавшееся газовая смесь имела бурый цвет.
Напишите уравнения описанных реакций.
- Газовую смесь аммиака и большого избытка воздуха пропустили при нагревании над платиной и продукты реакции через некоторое время поглотили раствором едкого натра. После выпаривания раствора был получен единственный продукт. Напишите уравнения описанных реакций.
- Через избыток раствора едкого кали пропустили бурый газ в присутствии большого избытка воздуха. В образовавшийся раствор добавили магниевую стружку и нагрели; выделившимся газом нейтрализовали азотную кислоту. Полученный раствор осторожно выпарили, твердый продукт реакции прокалили. Напишите уравнения описанных реакций.
- Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине.
Напишите уравнения описанных реакций.
- Нитрид магния обработали избытком воды. При пропускании выделившегося газа через бромную воду или через нейтральный раствор перманганата калия, так и при его сжигании образуется один и тот же газообразный продукт. Напишите уравнения описанных реакций.
- Один из продуктов взаимодействия аммиака с бромом – газ, входящий в состав атмосферы, смешали с водородом и нагрели в присутствии платины. Образовавшуюся смесь газов пропустили через раствор соляной кислоты и к полученному раствору добавили при небольшом нагревании нитрит калия. Напишите уравнения описанных реакций.
- Магний нагрели в сосуде, наполненном газообразным аммиаком. Образовавшееся вещество растворили в концентрированном растворе бромоводородной кислоты, раствор выпарили и остаток нагревали до появления запаха, после чего добавили раствор щелочи.
Напишите уравнения описанных реакций.
- Смесь азота и водорода последовательно пропустили над нагретой платиной и через раствор серной кислоты. В раствор добавили хлорид бария и после отделения выпавшего осадка – известковое молоко и нагрели. Напишите уравнения описанных реакций.
- Аммиак смешали с большим избытком воздуха, нагрели в присутствии платины и через некоторое время поглотили водой. Медная стружка, добавленная в полученный раствор растворяется с выделением бурого газа. Напишите уравнения описанных реакций.
- При нагревании вещества оранжевого цвета оно разлагается; среди продуктов разложения – бесцветный газ и твердое вещество зеленого цвета. Выделившийся газ реагирует с литием даже при небольшом нагревании. Продукт последней реакции взаимодействует с водой, при этом выделился газ с резким запахом, который может восстанавливать металлы, например медь из их оксидов.
Напишите уравнения описанных реакций.
- Металлический кальций прокалили в атмосфере азота. Продукт реакции обработали водой, выделившийся при этом газ пропустили в раствор нитрата хрома (III). Выпавший в ходе процесса серо-зеленый осадок обработали щелочным раствором пероксида водорода. Напишите уравнения описанных реакций.
- Смесь порошков нитрита калия и хлорида аммония растворили в воде и раствор осторожно нагрели. Выделившийся газ прореагировал с магнием. Продукт реакции внесли в избыток раствора соляной кислоты, при этом выделение газа не наблюдалось. полученную магниевую соль в растворе обработали карбонатом натрия. Напишите уравнения описанных реакций.
- Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдали сначала образование осадка, а затем – его полное растворение.
Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
- Магний растворили в разбавленной азотной кислоте, причем выделение газа не наблюдалось. Получившийся раствор обработали избытком раствора гидроксида калия при нагревании. Выделившийся при этом газ сожгли в кислороде. Напишите уравнения описанных реакций.
- Нитрат калия нагрели с порошкообразным свинцом до прекращения реакции. Смесь продуктов обработали водой, а затем полученный раствор профильтровали. Фильтрат подкислили серной кислотой и обработали иодидом калия. Выделившееся простое вещество нагрели с концентрированной азотной кислотой. В атмосфере образовавшегося при этом бурого газа сожгли красный фосфор. Напишите уравнения описанных реакций.
- Газ, образовавшийся при взаимодействии азота и водорода, разделили на две части.
Первую пропустили над раскаленным оксидом меди (II), вторую сожгли в кислороде в присутствии катализатора. Образовавшийся газ в избытке кислорода превратили в газ бурого цвета. Напишите уравнения описанных реакций.
- Разбавленная азотная кислота прореагировала с магнием с выделением бесцветного газа. В его атмосфере сожгли графит с образованием простого и сложного вещества. простое вещество при нагревании вступило в реакцию с кальцием, а сложное прореагировало с избытком раствора гидроксида натрия. Напишите уравнения описанных реакций.
- Аммиак поглотили азотной кислотой, полученную соль нагрели до образования только двух оксидов. Один из них прореагировал с натрием, а второй при высокой температуре прореагировал с медью. Напишите уравнения описанных реакций.
- Оксид азота (II) доокислили кислородом. Продукт реакции поглотили раствором гидроксида калия, через полученный раствор пропускали кислород до тех пор, пока в нем не образовалась только одна соль.
Образовавшуюся соль отделили и прокалили. Напишите уравнения описанных реакций.
- Кальций сожгли в атмосфере азота. Полученное вещество разложили кипящей водой. Выделившийся газ сожгли в кислороде в присутствии катализатора, а к суспензии прибавили раствор соляной кислоты. Напишите уравнения описанных реакций.
- Азот при нагревании на катализаторе прореагировал с водородом. Полученный газ поглотили раствором азотной кислоты, выпарили досуха и полученное кристаллическое вещество разделили на две части. Первую разложили при температуре 190 – 240°С, при этом образовался только один газ и водяные пары. Вторую часть нагрели с концентрированным раствором едкого натра. Напишите уравнения описанных реакций.
Понравилось это:
Нравится Загрузка…
Составление и разложение материи | manoa.hawaii.edu/ExploringOurFluidEarth
Название
Составление и разложение вещества
Ожидаемые результаты NGSS
MS-PS1-2 Анализ и интерпретация данных о свойствах веществ до и после взаимодействия веществ для определения наличия химической реакции произошел.
HS-PS1-2 Построить и пересмотреть объяснение результата простой химической реакции на основе самых удаленных электронных состояний атомов, тенденций в периодической таблице и знания закономерностей химических свойств.
Тело
Химические реакции
Соединения состоят из атомов двух или более элементов, соединенных химически. Это химическое соединение называется соединением . Существует много типов химических реакций, в результате которых образуются химические соединения, некоторые из них описаны в таблице 1.4. В химической реакции одно или несколько веществ подвергаются химическому изменению с образованием другого вещества или веществ. Исходными веществами являются реагентов . Новое вещество, полученное в результате химической реакции, называется 9.0017 продукт . Химическая реакция обычно записывается в следующем формате:
реагент + реагент → продукт + продукт
Стрелка указывает на то, что произошла химическая реакция.
Примером химической реакции является нейтрализация желудочной кислоты антацидом. Химическая формула антацида Ca(OH) 2 . Желудочная кислота представляет собой соляную кислоту (HCl). Когда эти два реагента объединяются, они реагируют с образованием хлорида кальция (CaCl 2 ) и вода (H 2 O). Вода образуется из OH в Ca(OH) 2 и H в HCl, чтобы получить HOH, другой способ записи H 2 O. Химическая реакция записывается в следующем формате:
Ca (OH) 2 + 2 HCl → CaCl 2 + 2 H 2 O
Эта реакция гласит: гидроксид кальция плюс соляная кислота дает хлорид кальция плюс вода . Примеры химических реакций приведены в таблице 1.4.
| Тип реакции | Реакция модели | Пример реакции |
|---|---|---|
| Состав |
А + В → АВ
Два или более реагента соединяются с образованием продукта |
4 Fe + O 2 → 2 Fe 2 O 3
железо плюс кислород дает оксид железа упрощенная реакция на образование ржавчины |
| Одиночная замена |
А + ХУ → АУ + Х
Производится одиночный переход между компонентами двух реагентов |
3 Ag 2 S + 2 Al → 6 Ag + Al 2 S 3
сульфид серебра плюс алюминий дает сульфид серебра и алюминия реакция для полировки потускневшего серебра в ванне с алюминиевой фольгой |
| Двойная замена |
AB + XY → AY + XB
Производится двойной переход между компонентами двух реагентов |
Ca(OH) 2 + 2 HCl → CaCl 2 + 2 H 2 O
гидроксид кальция плюс соляная кислота дает хлорид кальция плюс вода реакция на нейтрализацию желудочной кислоты антацидом |
| Горение |
C i H j +O 2 → CO 2 + H 2 O
Реагент, состоящий из углерода и водорода (углеводород), реагирует с кислородом с образованием двуокиси углерода и воды.
|
CH 4 + 2 O 2 → CO 2 + 2 H 2 O
метан плюс кислород дает углекислый газ и воду реакция сжигания метана (основного компонента природного газа) |
| Разложение |
АВ → А + В
Реагент распадается на два или более продуктов |
2 Н 2 О 2 → 2 Н 2 О + О 2
перекись водорода дает воду и газообразный кислород реакция разложения перекиси водорода |
Изображение
Рис. 1.8. Перекись водорода (H 2 O 2 ) легко распадается на H 2 O и O 2 на солнце, поэтому хранится в непрозрачной бутылке.
Изображение Джордана Вана
Соединения могут быть разложены на более простые соединения или их элементарные компоненты путем разрыва связей. Некоторые соединения разлагаются при нагревании или под воздействием солнечного света. Например, карбонат кальция (известняк) при нагревании разлагается на оксид кальция (негашеную известь) и углекислый газ. Свет разлагает перекись водорода на воду и кислород (рис. 1.8). Поскольку вода является чрезвычайно стабильным соединением, она не разлагается легко.
В процессе электролиза используется электричество для разрыва связей, что приводит к разложению материи. Электричество — это поток электронов, отрицательно заряженных частиц в атомах. При электролизе химическое изменение вызывается электричеством, протекающим через химическое соединение.
Задание
Исследование состава воды с помощью электролиза.
Аппарат Гофмана
Изображение
Рис. 1.11. Аппарат Гофмана
Изображение Джордана Вана
Аппарат Гофмана используется для электролиза воды. Это стеклянная U-образная трубка, заполненная трубкой чертополоха (рис. 1.11). В таблице 1.5 поясняются части аппарата Хоффмана.
| Детали с маркировкой на рис. 1.11 | Имя | Описание |
|---|---|---|
| А | Трубка чертополоха | Средняя трубка имеет наверху воронкообразную секцию, называемую чертополоховой трубкой, которая используется для наполнения аппарата водой для электролиза. |
| Б | U-образная трубка | U-образная трубка состоит из двух вертикальных цилиндров, соединенных горизонтальной трубкой. Маркировка на баллонах позволяет точно измерять объемы газов и жидкостей. |
| С | Платиновые электроды | Платиновые электроды находятся на дне цилиндров. Платиновые электроды проводят электричество и не подвержены коррозии. |
| Д | Запорные краны | Запорные краны можно открывать или закрывать для сбора газов. |
Мероприятие
Наблюдать за демонстрацией испытания пламенем для изучения газообразных продуктов электролиза. Демонстрационные материалы и процедура написаны в этом упражнении.
Электролиз
Рис. 1.12. Схема механизма электролиза воды; «e — » указывает на электроны.
Изображение Байрона Иноуэ
Электролиз использует электричество для расщепления воды на водород и кислород.
Химическая реакция, которая произошла на положительном электроде: 0003
Химическая реакция, которая произошла при отрицательный электрод:
2 H 2 O + 2e — → H 2 + 2OH —
Вода 90 Физические и химические изменения нагревается и кипит (рис. 1.13 А) происходит физическое изменение, когда жидкая вода испаряется в газообразный водяной пар.

Изображение
Подпись к изображению
Рис. 1.13. ( A ) Кипячение воды является примером физического изменения. ( B ) Электролиз является примером химического изменения.
Авторские права на изображение и источник
Изображение A Джордана Вана; Изображение B Byron Inouye
При электролизе воды (рис. 1.13 Б) из жидкой воды образуются газообразные водород и кислород. Электролиз воды вызывает химическое изменение, при котором молекулы воды расщепляются с образованием водорода и кислорода — двух веществ, которые химически отличаются от воды. Разложение воды затруднено и не может быть достигнуто только путем нагревания. Воду не разбивает даже жар вулканического извержения!
Сохранение материи
Важной характеристикой материи является то, что она никогда не может быть создана или уничтожена, а только преобразована.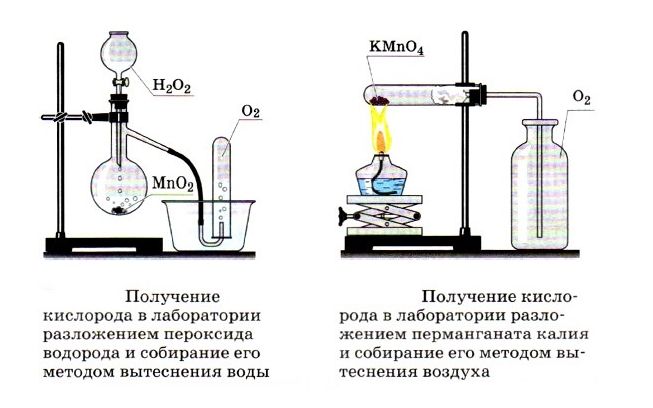
- Материя состоит из маленьких частиц, называемых атомами.
- Атомы одного и того же элемента одинаковы; атомы разных элементов различны.
- Материя не может быть создана или уничтожена.
- Атомы могут соединяться в различных соотношениях, образуя соединения.
- В химических реакциях атомы перестраиваются, образуя новые соединения.
Атомная теория Дальтона составляет основу современной атомной теории.
Странная наука
Дальнейшие исследования
Содержание
Составление и разложение вещества
Репрезентативное изображение
Изображение
Электролиз воды | Энергетические основы для химии в старших классах
- Обзор для учителя
- Подготовка
- Демонстрация
- Обсуждение со студентами
- Пояснение
- Расширения
Обзор учителя
Резюме
В этой демонстрации учащиеся исследуют идею о том, что энергию батареи можно использовать для запуска химической реакции, которая не происходит самопроизвольно, например, расщепление молекул воды с образованием водорода и кислорода.
Цель
Учащиеся узнают об использовании внешнего источника энергии для запуска химической реакции.
Безопасность
Убедитесь, что вы и учащиеся носите подходящие защитные очки.
Материалы
- 9-вольтовая батарея
- Две металлические кнопки
- Вода
- Английская соль (MgSO 4 • 7 H 2 O)
- Чистая, пустая, прозрачная и бесцветная пластиковая бутылка для воды с крышкой и удаленной этикеткой
- Ножницы
- Черный перманентный маркер
- Химический стакан или пластиковая чашка
- Бумажные полотенца или глина для лепки
Необходимое время
Часть одного урока, примерно 10–15 минут.
Демонстрационные советы
Соль Эпсома можно приобрести в местных аптеках, где она продается как слабительное и как средство для добавления в ванну с теплой водой для лечения боли. Можно использовать пластиковые контейнеры, отличные от бутылки с водой, если у контейнера плоское дно для легкого подключения к контактам батареи, а пластик достаточно тонкий, чтобы легко проталкивать кнопки.
Интеграция в учебную программу
Эта демонстрация может вписаться в раздел по химическим реакциям или термохимии.
Процедура для учителя
Подготовка
- Снимите крышку с чистой, пустой, прозрачной и бесцветной пластиковой бутылки для воды. Переверните крышку так, чтобы верхняя часть крышки касалась двух контактов 9-вольтовой батареи. Отцентрируйте крышку над двумя контактами. Используя черный перманентный маркер, сделайте две точки на внутренней стороне крышки, по одной над центром каждого контакта.
- Поместите крышку на твердую поверхность верхней частью крышки вверх. Вставьте металлическую кнопку в верхнюю часть крышки прямо над одной из точек. Вставьте вторую кнопку в крышку прямо над второй точкой. Две кнопки не должны соприкасаться.
- С помощью ножниц отрежьте верхнюю половину бутылки, чтобы она выглядела как воронка.
Закрутите крышку обратно на бутылку.
Демонстрация
- Покажите учащимся верхнюю половину бутылки, особенно две металлические кнопки, продетые сквозь крышку.
- Наполните нижнюю половину разрезанной бутылки водой примерно наполовину. Добавьте примерно чайную ложку английской соли. Помешивать, пока большая часть соли не растворится.
- Налейте раствор английской соли в верхнюю часть бутылки (держите ее крышкой вниз).
- Попросите студента-добровольца понаблюдать за решением, особенно за двумя точками металлических кнопок. Есть ли признаки реакции?
- Поместите две металлические кнопки так, чтобы каждая кнопка касалась одного из контактов на 9-вольтовая батарея. Попросите добровольца еще раз понаблюдать за раствором. Есть ли признаки реакции?
- Батарейку можно поместить на дно стакана или прозрачного бесцветного пластикового стакана, удерживая вертикально с помощью бумажных полотенец или глины для лепки.
Затем верхнюю часть бутылки можно поставить на батарею с большей устойчивостью, если инструктор хочет показать ее поближе к остальной части класса.
Обсуждение со студентами
- Какие существуют доказательства того, что реакция происходит, когда контакты батареи касаются металлических кнопок?
Пузырьки одного или нескольких газов образуются и поднимаются из каждой кнопки.
- Есть ли разница в количестве газа, образующегося при каждом контакте батареи?
Да, на одном из соединений образуется больше пузырьков.
- Может ли разница, описанная в вопросе 2, быть связана с разницей в гвоздях? Что можно сделать с аппаратом, чтобы потенциально подтвердить идею о том, что контакт батареи ответственен за 9?0619 .
Можно повернуть контакты батареи так, чтобы каждый контакт касался противоположной кнопки. Контакт батареи, который произвел больше пузырьков в первый раз, должен по-прежнему производить больше пузырьков при прикосновении к любой кнопке.
- Для чего нужен аккумулятор?
Батарея запускает реакцию, которую мы не наблюдали самопроизвольно без этого дополнительного внешнего источника энергии.
- Зачем в воду добавляют английскую соль?
Английская соль является электролитом и служит для проведения электричества через раствор. Электричество от батареи может проходить через раствор и между двумя кнопками.
6. Каково сбалансированное уравнение распада молекул воды?
7. Если наблюдаемая нами реакция представляет собой расщепление молекул воды, то какой газ может выделяться при контакте батареи и почему?
В результате реакции распада молекул воды образуются два газа: H 2 и O 2 . В уравнении получается в два раза больше газообразного водорода, чем газообразного кислорода. Контакт батареи, который производит больше пузырьков, будет производить газообразный водород.
8.
Можно собирать образующиеся газы и проверять их на известные свойства H 2 и О 2 газы.
Пояснение
Разделение слова «электролиз» на составные части обобщает его значение — использование электричества (электро-) для разрушения (-лиза) чего-либо. В этой демонстрации электричество, подаваемое 9-вольтовой батареей, используется для расщепления молекул воды, в результате чего образуются газообразные водород и кислород.
Идея включения энергии в качестве реагента или продукта в химическое уравнение может быть использована для иллюстрации потребности в дополнительной внешней энергетической силе для управления реакцией, которая обычно происходит
не происходит самопроизвольно и связать демонстрацию с представлениями об экзотермических и
эндотермических реакциях.
Например, Химия в Сообществе описывает:
…если определенная химическая реакция является экзотермической (с выделением тепловой энергии), то обратная реакция является эндотермической (преобразование тепловой энергии в потенциальную). Например, сжигание газообразного водорода с образованием воды является экзотермическим процессом. Энергия, выделяемая при образовании связей H–O в молекулах воды, больше, чем необходимая для разрыва связей в молекулах h3 и O2:
Следовательно, разделение воды на элементы — обратная реакция — должна быть эндотермической, количество энергии равно количеству выделяющейся при образовании воды из газообразных H 2 и O 2 .
Удлинители
Предложите учащимся разработать метод сбора газов на демонстрации и описать, как их можно проверить, чтобы определить, являются ли они h3 и O2, и какие из них являются какими. Стеклянные трубки, наполненные раствором английской соли, можно перевернуть над двумя кнопками для сбора газов; сбор заметного количества газа может занять значительное время.
 Образовавшееся вещество поместили в воду. образовавшийся при этом газ пропустили через свежеосажденный гидроксид меди (II). Напишите уравнения описанных реакций.
Образовавшееся вещество поместили в воду. образовавшийся при этом газ пропустили через свежеосажденный гидроксид меди (II). Напишите уравнения описанных реакций. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали хлоридом бария. Раствор профильтровали, а фильтрат смешали с раствором нитрита натрия и нагрели. Напишите уравнения описанных реакций.
Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали хлоридом бария. Раствор профильтровали, а фильтрат смешали с раствором нитрита натрия и нагрели. Напишите уравнения описанных реакций. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций. Образовавшееся вещество внесли в подкисленный серной кислотой раствор перманганатом калия, при этом раствор обесцветился. Азотсодержащий продукт реакции поместили в раствор едкого натра и добавили цинковую пыль, при этом выделился газ с резким характерным запахом. Напишите уравнения описанных реакций.
Образовавшееся вещество внесли в подкисленный серной кислотой раствор перманганатом калия, при этом раствор обесцветился. Азотсодержащий продукт реакции поместили в раствор едкого натра и добавили цинковую пыль, при этом выделился газ с резким характерным запахом. Напишите уравнения описанных реакций. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций. Первую пропустили над раскаленным оксидом меди (II), вторую сожгли в кислороде в присутствии катализатора. Образовавшийся газ в избытке кислорода превратили в газ бурого цвета. Напишите уравнения описанных реакций.
Первую пропустили над раскаленным оксидом меди (II), вторую сожгли в кислороде в присутствии катализатора. Образовавшийся газ в избытке кислорода превратили в газ бурого цвета. Напишите уравнения описанных реакций. Образовавшуюся соль отделили и прокалили. Напишите уравнения описанных реакций.
Образовавшуюся соль отделили и прокалили. Напишите уравнения описанных реакций. 4. Типы обычных химических реакций с модельными реакциями и примерами реакций
4. Типы обычных химических реакций с модельными реакциями и примерами реакций  Нижние индексы i и j относятся к числу атомов C и H, которые различны в разных углеводородах.
Нижние индексы i и j относятся к числу атомов C и H, которые различны в разных углеводородах. 
 Затем верхнюю часть бутылки можно поставить на батарею с большей устойчивостью, если инструктор хочет показать ее поближе к остальной части класса.
Затем верхнюю часть бутылки можно поставить на батарею с большей устойчивостью, если инструктор хочет показать ее поближе к остальной части класса. 
Добавить комментарий