Содержание
Выход реакции. Задачи на выход
Задачи на выход продукта химической реакции. Как решать задачи на выход продукта реакции. Что такое выход продукта химической реакции. Теоретическое и практическое количество продукта химической реакции.
При решении задач на расчеты по уравнениям химических реакций мы принимаем, что в ходе реакции образуется точно рассчитанное количество продукта, исходя из мольного соотношения реагентов и продуктов. Количество продукта реакции, которое должно получится из реагентов согласно стехиометрическим расчетам — это теоретическое количество (масса, объем) или теоретический выход продукта реакции nтеор.
Однако на практике это соотношение не выполняется, и в большинстве случаев образуется меньшее количество продукта реакции, чем было рассчитано — практическое количество (масса, объем) или практический выход продукта реакции nпр.
Практический и теоретический выход не совпадают в силу разных причин — неэффективные соударения реагирующих частиц, побочные процессы, потери в ходе проведения реакции и т. д.
Обратите внимание! Понятия теоретического или практического количества реагента не существует. Ведь мы всегда берем определенное количество реагентов. А вот вступать в реакцию не полностью реагенты могут.
Массовая (мольная, объемная) доля выхода продукта реакции η или ω — это соотношение массы (количества вещества, объема) продукта, которая практически получена в ходе реакции, mпр., к массе (количеству, объему) продукта, которая рассчитана теоретически, mтеор.:
η = mпр./mтеор.
Массовую (мольную, объемную) долю выхода продукта реакции можно выражать в долях, а можно в процентах:
η = mпр./mтеор.·100%
Рассмотрим несколько задач на определение и использование выхода продукта реакции.
1. Какое количество вещества аммиака получится при действии избытка раствора гидроксида натрия на 500 г сульфата аммония, если выход в данной реакции 70%?
Решение.
2NaOH + (NH4)2SO4 = Na2SO4 + 2NH3 + 2H2O
Количество вещества сульфата аммония:
n((NH4)2SO4) = m/M = 500/132 = 3,79 моль
Теоретическое количество аммиака:
nтеор.(NH3) = 2·n((NH4)2SO4) = 2·3,79 = 7,58 моль
Зная мольную долю выхода продукта реакции, определим практический выход аммиака:
nпр.(NH3) = η·nтеор.(NH3) = 0,7·7,58 = 5,3 моль
Ответ: nпр.(NH3) = 5,3 моль
2. При хлорировании метана объемом 112 л (н. у.) получен дихлорметан массой 255 г. Определите долю выхода дихлорметана.
Решение.
CH4 + 2Cl2 = CH2Cl2 + 2HCl
Количество вещества метана:
n(CH4) = V/Vm = 112/22,4 = 5 моль
Теоретическое количество дихлорметана:
nтеор.
mтеор.(CH2Cl2) = M·nтеор.(CH2Cl2) = 85 г/моль·5 моль = 425 г
Масса дихлорметана, которая приведена в условии задачи — это практический выход дихлорметана.
Доля выхода дихлорметана:
η = mпр./mтеор. = 255/425 = 0,6 или 60%
Ответ: выход продукта реакции 60%
3. Определите массу оксида меди (II), которая потребуется для получения 500 г нитрата меди, если доля выхода в реакции взаимодействия оксида меди с HNO3 составляет 92%?
4. Определите объем (н.у., л) аммиака, который получится при действии избытка раствора гидроксида натрия на 48 г карбоната аммония, если выход в реакции составляет 70%?
5. Определите массу соли, г, которая образуется при растворении в избытке азотной кислоты 80 г оксида меди (II), если выход в реакции составляет 80%?
6.
7. Рассчитайте массу оксида магния, которая образуется при разложении гидроксида магния массой 50 г, если реакция разложений прошла с выходом 95,5%.
8. Какая масса бензола (кг) может получиться из 369,6 м3 (н.у.) ацетилена, если доля выхода бензола составила 65% от теоретически возможного?
9. Определите массу спирта, полученного при гидратации 40 л пропилена (н.у.), если доля выхода продукта реакции составляет 65% от теоретически возможного.
10. Определите долю выхода в реакции каталитического окисления аммиака кислородом, если при окислении 10 моль аммиака образуется 200 л оксида азота (II) при н.у.?
11. Пары брома объемом 20 л смешали с избытком водорода, в результате из смеси выделили 32 л бромоводорода.
12. Оксид кальция массой 0,64 кг нагрели до 1200° С с достаточной массой оксида кремния (IV). Масса образовавшегося силиката кальция оказалась равной 1,024 кг. Определите выход (%) реакции соединения.
13. Из 36 г метанола было получено 24 г диметилового эфира. Рассчитайте выход реакции дегидратации
14. Углекислый газ объемом 6 л (н.у.) пропустили над раскалённым углем, продукт реакции пропустили через избыток известковой воды, после чего собрали 7,2 л (н.у.) газа. Определите степень превращения углекислого газа, %.
15. Определите массу, г нитрата аммония, которая содержалась в растворе, если при действии на этот раствор избытка гидроксида кальция выделилось 6 г аммиака. Реакция прошла с выходом 88,2 %.
16. При термическом разложении не загрязненного примесями карбоната кальция образовалось 20 г оксида кальция.
17. Какой объем пропана (н.у.) потребуется для получения 42 г пропена, если доля выхода продуктов реакции составляет 60% от теоретически возможного?
18. При бромировании пентена-2 массой 8,4 г получен 2,3-дибромпентан массой 24,3 г. Определите долю выхода продукта реакции.
19. Из 69 г этанола получен бутадиен-1,3 массой 36,85 г. Определите массовую долю выхода продукта реакции.
20. При бромировании 5,4 г дивинила избытком брома образуется 28,2 г 1,2,3,4-тетрабромбутана. Определите выход продукта реакции.
21. Определите, какая масса 2-метилбутана необходима для получения 46,24 г изопрена, если доля выхода продукта реакции составляет 85%?
22. Определите объем метана, который потребуется для получения 63 л ацетилена (н.
23. Определите, какую массу уксусного альдегида можно получить по реакции Кучерова из 11,2 л ацетилена (н. у.), если доля выхода продуктов реакции составляет 80% от теоретически возможного?
24. При действии избытка воды на 48 г технического карбида кальция, содержащего 10% примесей, образовался ацетилен объемом 10,08 л (н.у.). Определите долю выхода продукта реакции.
25. Определите массу технического карбида алюминия, содержащего 7% примесей, необходимого для получения 56 л метана (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
26. Из 179,2 л бутана (н.у.) с объемной долей примесей 25% двухстадийным синтезом получен бутанол-2 массой 159,84 г. Доли выхода продуктов на первой и второй стадиях одинаковы. Определите доли выхода продуктов реакций.
27. Циклогексан массой 16 г сожгли в избытке кислорода и полученный углекислый газ пропустили через избыток раствора гидроксида кальция, в результате чего выпал осадок массой 90 г.
28. При нитровании 46,8 г бензола получен нитробензол массой 66,42 г. Определите выход продуктов реакции.
Понравилось это:
Нравится Загрузка…
как увеличить, способы расчета, формула, как найти долю
Выход продукта химической реакции
Определение
Выход продукта химической реакции — масса продукта, образовавшегося в результате реакции.
Может быть:
- теоретическим — рассчитанным по уравнению реакции;
- фактическим — полученным реально в процессе химической реакции.
Если эти два показателя равны, то считают, что реакция идет с количественным выходом. Такую реакцию называют стехиометрической.
Но большинство реакции на практике не дают количественного выхода по следующим причинам:
- при взаимодействии органических соединений образуются побочные продукты;
- обратимость реакций;
- реагенты имеют примеси;
- потери газообразных веществ, если оборудование недостаточно герметично;
- потери при кристаллизации и др.
Поэтому для определения эффективности реакции было введено понятие:
Формула
относительный выход =фактический=практический выходтеоретический выход ×100%.
Для реакции с количественным выходом относительный выход равен 100%.
Выход продукта реакции определяется двумя параметрами: селективностью и степенью превращения.
Понятие селективности и материального баланса
Определение
Селективность — критерий, с помощью которого в химии определяют отношение массы определенного (целевого) продукта к общей массе полученных продуктов.
Определение
Степень превращения (конверсии) показывает отношение количества исходного реагента (обычно более дорогостоящего) к количеству полученного целевого продукта.
Например, этот критерий позволяет оценить, какое количество метана Ch5 превратилось в угарный газ CO при конверсии водяным паром. Может быть выражена не только через количество вещества, но и через любые пропорциональные ему величины: массу, объем.
Для обеспечения максимального выхода целевого продукта недостаточно только высокой степени конверсии (значительное количество вещества может вступить в реакцию, но не участвовать в образовании целевого продукта) или хорошей селективности, выход продукта определяется совокупностью этих факторов.
Например, N0 моль исходного вещества А вступило в реакцию, из них прореагировало Nx моль со следующим распределением:
- на образование продукта B было израсходовано NB моль;
- на образование побочных продуктов C и D было израсходовано NC и ND моль вещества A.
Тогда селективность S реакции по целевому продукту B составит:
- SB=NB / (NB+NC+ND) или SB=NB / Nx
Степень превращения реагента A для данного примера будет равна соотношению между числом моль прореагировавшего вещества A к общему числу моль, которые были затрачены на реакцию:
- KA=Nx / N0
Выход продукта ηB в этом примере будет равен соотношению между числом моль реагента A, пошедшего на образование целевого продукта, к числу моль, которые были затрачены на реакцию:
- ηB= NB / N0
Таким образом, между выходом продукта B, селективностью процесса относительно образования B и степенью превращения исходного реагента A существует взаимосвязь:
- ηB= SB × KA.
Селективность подразделяют на:
- полную (интегральную) — соотношение между количеством полученного целевого продукта и всех продуктов процесса;
- мгновенную (дифференциальную) — соотношение между скоростью целевой реакции и скоростью расходования исходного реагента.
Селективность важна для катализаторов, чтобы избирательно увеличивать скорость целевой реакции при наличии нескольких побочных. Высокой селективностью отличаются ферменты (95 — 100%), для гетерогенных катализаторов этот показатель достигает 70%. Гомогенные занимают промежуточное значение.
Выход, степень превращения и селективность — величины безразмерные, учитываются при составлении материального баланса процесса.
Определение
Материальный баланс (баланс масс) выводится на основании закона сохранения массы вещества.
Правило
Для химических процессов можно сформулировать его так: суммарная масса исходных веществ в начале реакции должна быть равна суммарной массе всех полученных продуктов (целевых и побочных), включая неиспользованные реагенты и растворители, в конце реакции.
Материальный баланс составляется с расчетом расхода реагентов и полученных продуктов на единицу основного продукта. Поскольку на производство вещества поступают в виде смесей, при составлении материального баланса учитывается масса всех компонентов отдельно для твердой, жидкой и газовой фаз. Для процессов, которые идут в несколько стадий, баланс составляется для каждой стадии отдельно.
Материальный баланс, как и выход продукта, может быть:
- теоретическим — определяют по результатам расчетов химиков-технологов на основании экспериментальных выработок;
- фактическим — получают в ходе производственного процесса. Всегда меньше теоретического из-за потерь.
Как увеличить выход продукта реакции, способы расчета, формулы
Фактический выход конкретного химического процесса можно увеличивать при регулировании следующих факторов:
- температура;
- давление;
- скорость перемешивания;
- присутствие катализатора;
- чистота исходных материалов;
- эффективность процесса извлечения продуктов;
- использование одного или нескольких реагентов в избытке и др.
Для каждой химической реакции, лежащей в основе промышленного производства, необходимо эффективно использовать ресурсы, максимально повысить выход целевого продукта, но при этом он должен быть надлежащего качества и в достаточном количестве. Для это обязательно рассчитывают выход продукта.
Расчет выхода продукта
Формула
- массовая доля выхода продукта ω (омега) =mпрmтеор ×100%;
- объемная доля выхода продукта ω (омега) =VгазпрVгазтеор ×100%.
Например, если процент выхода равен ω=80%, это означает, что количество полученного продукта составляет 80% от теоретически возможного.
Выход продукта реакции можно выразить также через коэффициент, обозначается буквой η (эта):
Формула
Выход продукта η= νпрνтеор=mпрmтеор =VгазпрVгазтеор.
Как рассчитать теоретический выход продукта реакции, примеры задач
Алгоритм расчета теоретического выхода ηтеор приведен на примере решения следующей задачи:
При взаимодействии 9,84 г оксида железа (III) и 12 г монооксида углерода СО образовались железо и углекислый газ.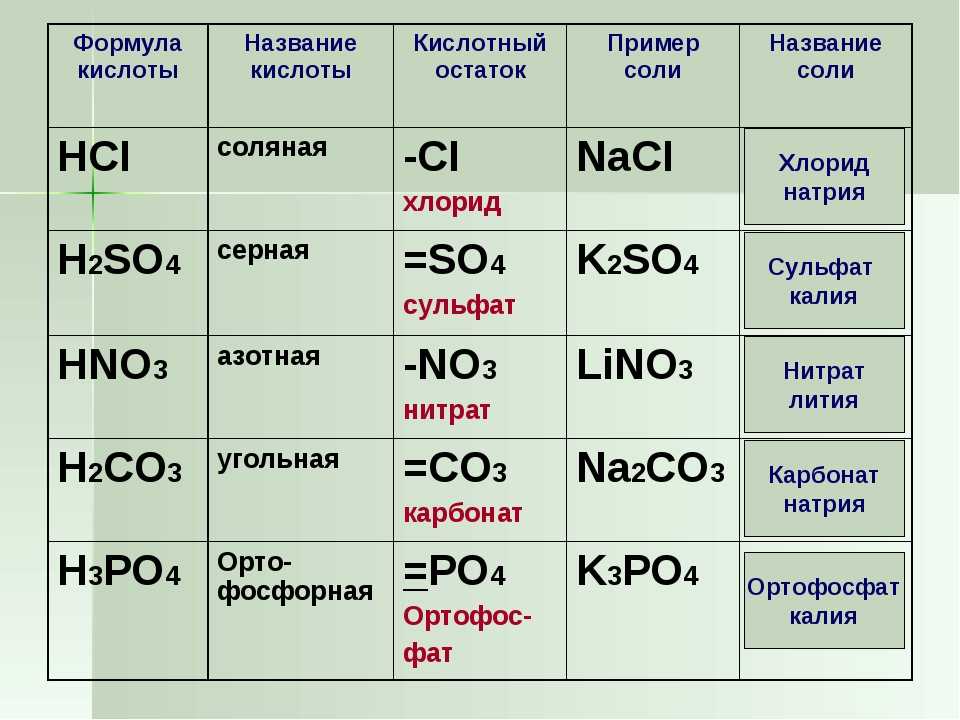
1. Записать уравнение химической реакции:
- Fe2O3 + CO → Fe + CO2↑;
- реагенты (исходные вещества) → продукты реакции.
2. Расставить коэффициенты так, чтобы в обеих частях уравнения количество атомов каждого элемента было одинаковым:
- Fe2O3 + 3CO → 2Fe + 3CO2↑;
- 2 атома Fe, 3 атома C, 6 атомов O = 2 атома Fe, 3 атома C, 6 атомов O.
3. Вычислить молярные массы реагентов и целевого продукта (для взятого примера — Fe). Из таблицы Менделеева или справочника узнать атомные массы Ar всех составляющих элементов и посчитать молярные массы М 1 моля каждого исходного вещества и целевого продукта:
- M(Fe2O3)= Ar(Fe)×2 + Ar(O)×3= 56×2 + 16×3=160 г/моль,
- M(CO)= Ar(C) + Ar(O)= 12 + 16= 28 г/моль,
- M(Fe)= Ar(Fe)= 56 г/моль.
4. Найти количество вещества ν каждого реагента:
- ν(Fe2O3)=mFe2O3MFe2O3=9,84 г160 г/моль=0,0615 моль;
- ν(CO)=mCOMCO=12 г28 г/моль=0,43 моль.
Примечание
Если в условии задачи указана масса только одного реагента, то он считается ключевым, и все дальнейшие расчеты выполняются по нему; ν второго исходного вещества вычислять не нужно (пункт 5 пропускается).
5. Для определения ключевого компонента — реагента, который расходуется быстрее остальных, следует определить продолжительность реакции и теоретический выход:
- составляется соотношение числа молей одного реагента к числу молей другого:
ν(CO)ν(Fe2O3)=0,43 моль0,0615 моль=7.
Это говорит о том, что количество используемого для реакции CO в 7 раз больше, чем количество Fe2O3;
- сравниваются стехиометрические коэффициенты при реагентах, которые показывают, сколько молекул каждого вещества требуется для проведения реакции:
Fe2O3 + 3CO → 2Fe + 3CO2↑.
На одну молекулу Fe2O3 должно приходится 3 молекулы CO.
Можно сделать заключение, что CO взят в избытке и расчет следует вести по Fe2O3, который является ключевым компонентом.
6. Fe2O3160 г/моль 9.84 г+ 3CO28 г/моль12 г→ 2Fe56 г/мольmтеор г+ 3CO2↑.
Правило
По закону кратных соотношений, чтобы найти теоретическое количество целевого продукта νтеор, нужно количество расчетного компонента поделить на коэффициент при нем и умножить на коэффициент при целевом продукте:
νтеор= 0,0615 моль :1 × 2= 0,123 моль — это и есть теоретический выход продукта.
7. Масса продукта (Fe), соответствующая данному количеству вещества, будет равна:
mтеор= νтеор×Mпродукта= 0,0615 моль× 56 г/моль= 6,888 г.
Примечание
Если в задаче требуется рассчитать теоретический выход одного или нескольких побочных продуктов, то для каждого из них вычисляется молярная масса (пункт 3), а затем последовательность действий повторяется с 6 пункта.
На практике также важен расчет фактического выхода продукта ηпракт или массовой доли выхода продукта ω в %.
Три типа задач:
| Тип задачи | Решение (см. Алгоритм) Алгоритм) |
|
Известно: масса реагента (одного или нескольких) и масса продукта. Нужно найти: практический выход ηпракт или массовую (объемную) долю ω в % одного или нескольких продуктов реакции. Пример. При взаимодействии 6,9 г натрия с 100 г воды получили 3 л водорода (н.у.). Вычислите объёмную долю выхода газа (в %). |
1. Записать уравнение реакции: Na+ h3O → NaOН + h3↑. 2. Расставить коэффициенты: 2Na+ 2h3O → 2NaOН + h3↑. 3. Вычислить молярные массы реагентов и целевого продукта:
Так как нужно узнать объемную долю выхода продукта, то вместо M(h3) берется значение молярного объема Vm(h3)= 22,4 л/моль (по закону Авогадро, 1 моль любого газа (н.у) занимает объем 22,4 л). 4. Вычислить количество вещества для реагентов:
5.
6. Чтобы найти теоретическое количество целевого продукта νтеор, нужно количество ключевого компонента поделить на коэффициент при нем и умножить на коэффициент при целевом продукте: νтеор(Н2)= 0,3:2×1= 0,15 моль. 7. Теоретический объем Vтеор(Н2)= νтеор(Н)×Vm(h3)= 0,15 моль×22,4 л/моль= 3,36л. 8. Объемная доля выхода продукта: ω=VпрVтеор ×100%=3л3,36л×100%=89,3% |
|
Известно: Масса реагента и практический выход продукта. Нужно найти: Массу продукта реакции. Пример. Какой объем аммиака в литрах (н.у.) можно получить при взаимодействии 13,4 моль водорода с азотом, если практический выход η(Nh4)=0,43? |
1+2. N2 + 3h3 → 2Nh4. Пункты 3 и 4 не нужны, так как в условии уже указано количество вещества реагента:
Поскольку дано количество вещества только одного реагента, то расчет ведется по нему. Пункт 5 пропускаем. 6. Чтобы найти теоретическое количество целевого продукта νтеор, нужно количество ключевого компонента поделить на коэффициент при нем и умножить на коэффициент при целевом продукте: νтеор(NН3)=13,4:3×2= 8,9 моль. 7. η=\νпр\νтеор , тогда фактическое количество вещества νпракт= η×νтеор= 0,43×8,9 моль = 3,83 моль. 8. Фактический объем Vпракт= νпракт × Vm= 3,83 моль × 22,4 л/моль= 85,8 л. |
|
Известно: Масса продукта и его практический выход. Нужно найти: массу реагента. Пример. Сколько граммов водорода требуется для реакции с углеродом при получении бензола, C6H6, если теоретический выход 105,3 г, а массовая доля выхода равна 95,8%? |
1+2. 6C + 3h3 → C6H6. 3. Вычислить молярные массы реагентов и целевого продукта:
4. Вычислить mпракт. Так как ω =mпрmтеор ×100%,то mпракт=mтеор×ω/100. mпракт(C6H6)= 105,3 г× 95,8/100=100,9 г. 5. Вычислить количество вещества продукта реакции: ν(C6H6)=m(C6H6)M(C6H6)=100,9 г78,05 г/моль=1,3 моль. 6. Чтобы найти количество реагента, нужно количество продукта реакции разделить на коэффициент при нем и умножить на коэффициент при реагенте: ν(h3)=1,3:1×3= 3,9 моль— количество водорода, необходимое для реакции. 7. Масса водорода m(h3)= ν(h3)× M(Н2)= 3,9 моль × 2,016 г/моль= 7,8 г. |
Химические формулы – химия
Атомы, молекулы и ионы
OpenStaxCollege
[латексная страница]
Цели обучения
К концу этого раздела вы сможете:
- Символизировать состав молекул, используя молекулярные формулы и эмпирические формулы
- Представьте расположение связей атомов внутри молекул, используя структурные формулы
Молекулярная формула представляет собой представление молекулы, в котором используются химические символы для обозначения типов атомов, за которыми следуют нижние индексы, показывающие количество атомов каждого типа в молекуле.
Структурная формула соединения дает ту же информацию, что и его молекулярная формула (типы и количество атомов в молекуле), но также показывает, как атомы связаны в молекуле. Структурная формула метана содержит символы для одного атома C и четырех атомов H, указывающие на количество атомов в молекуле ([ссылка]). Линии представляют собой связи, удерживающие атомы вместе. (Химическая связь — это притяжение между атомами или ионами, удерживающее их вместе в молекуле или кристалле.) Мы обсудим химические связи и увидим, как предсказать расположение атомов в молекуле позже. А пока просто знайте, что линии указывают на то, как атомы связаны в молекуле. Шарико-стержневая модель показывает геометрическое расположение атомов с размерами атомов не в масштабе, а модель заполнения пространства показывает относительные размеры атомов.
Молекула метана может быть представлена в виде (а) молекулярной формулы, (б) структурной формулы, (в) шаростержневой модели и (г) модели заполнения пространства. Атомы углерода и водорода представлены черными и белыми сферами соответственно.
Хотя многие элементы состоят из дискретных отдельных атомов, некоторые существуют в виде молекул, состоящих из двух или более атомов элемента, химически связанных друг с другом. Например, большинство образцов элементов водорода, кислорода и азота состоят из молекул, каждая из которых содержит два атома (называемых двухатомными молекулами), и поэтому имеют молекулярные формулы H 2 , О 2 и N 2 соответственно. Другими элементами, обычно встречающимися в виде двухатомных молекул, являются фтор (F 2 ), хлор (Cl 2 ), бром (Br 2 ) и йод (I 2 ). Наиболее распространенная форма элемента серы состоит из молекул, состоящих из восьми атомов серы; его молекулярная формула S 8 ([ссылка]).
Молекула серы состоит из восьми атомов серы и поэтому записывается как S 8 . Его можно представить в виде (а) структурной формулы, (б) шаростержневой модели и (в) модели заполнения пространства. Атомы серы представлены желтыми сферами.
Важно отметить, что нижний индекс после символа и число перед символом не представляют одно и то же; например, H 2 и 2H представляют совершенно разные виды. H 2 представляет собой молекулярную формулу; он представляет собой двухатомную молекулу водорода, состоящую из двух атомов элемента, которые химически связаны друг с другом. Выражение 2H, с другой стороны, указывает на два отдельных атома водорода, которые не объединены в одно целое. Выражение 2H 2 представляет собой две молекулы двухатомного водорода ([ссылка]).
Символы H, 2H, H 2 и 2H 2 представляют очень разные объекты.
Соединения образуются при химическом соединении двух или более элементов, что приводит к образованию связей.
(a) Белая составная двуокись титана обеспечивает эффективную защиту от солнца. (б) Кристалл диоксида титана, TiO 2 , содержит титан и кислород в соотношении 1 к 2. Атомы титана окрашены в серый цвет, а атомы кислорода — в красный.
Как обсуждалось ранее, мы можем описать соединение с молекулярной формулой, в которой нижние индексы указывают реальное число атомов каждого элемента в молекуле соединения. Во многих случаях молекулярная формула вещества получается из экспериментального определения как его эмпирической формулы, так и его молекулярной массы (суммы атомных масс всех атомов, составляющих молекулу). Например, экспериментально можно определить, что бензол содержит два элемента, углерод (С) и водород (Н), и что на каждый атом углерода в бензоле приходится один атом водорода. Таким образом, эмпирическая формула CH. Экспериментальное определение молекулярной массы показывает, что молекула бензола содержит шесть атомов углерода и шесть атомов водорода, поэтому молекулярная формула бензола C 6 H 6 ([ссылка]).
Бензол, C 6 H 6 , производится при переработке нефти и имеет множество промышленных применений.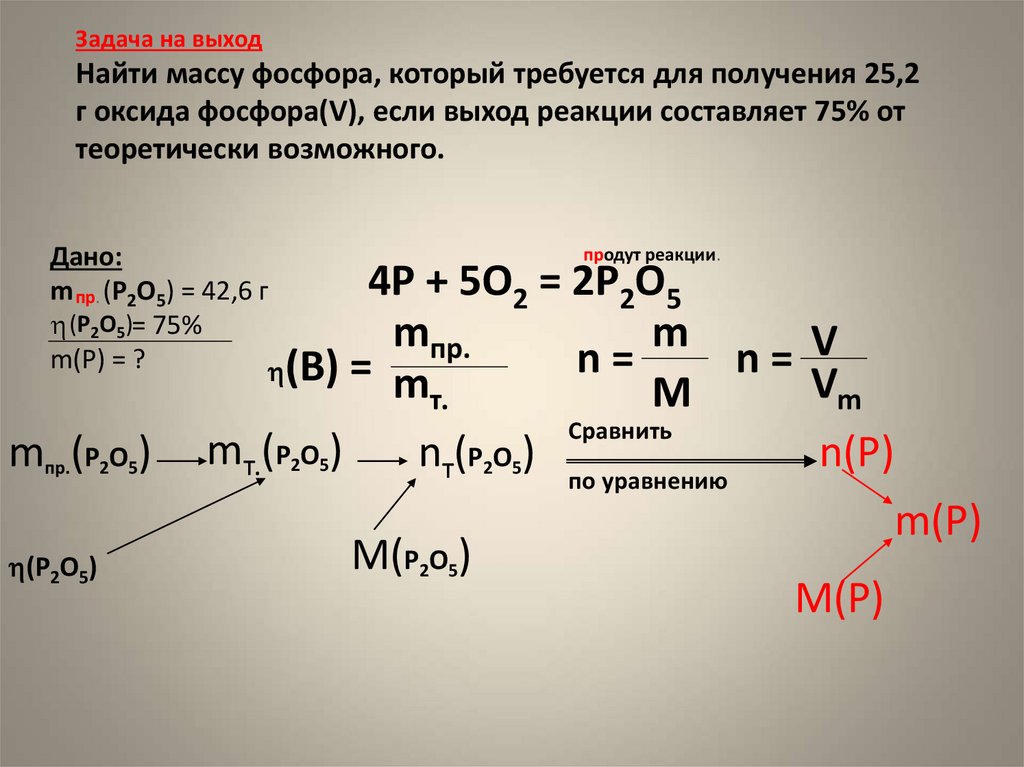
Если мы знаем формулу соединения, мы можем легко определить эмпирическую формулу. (Это своего рода академическое упражнение; на практике обычно используется обратная хронология.) Например, молекулярная формула уксусной кислоты, компонента, придающего уксусу его острый вкус, C 2 Н 4 О 2 . Эта формула указывает на то, что молекула уксусной кислоты ([ссылка]) содержит два атома углерода, четыре атома водорода и два атома кислорода. Соотношение атомов 2:4:2. Деление на наименьший общий знаменатель (2) дает простейшее целочисленное соотношение атомов, 1:2:1, поэтому эмпирическая формула CH 2 O. Обратите внимание, что молекулярная формула всегда является целым числом, кратным эмпирическая формула.
(a) Уксус содержит уксусную кислоту, C 2 H 4 O 2 , который имеет эмпирическую формулу CH 2 O.
Эмпирические и молекулярные формулы
Молекулы глюкозы (сахара крови) содержат 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Каковы молекулярная и эмпирическая формулы глюкозы?
Раствор
Молекулярная формула C 6 H 12 O 6 , потому что одна молекула фактически содержит 6 атомов C, 12 H и 6 атомов O. Простейшее целочисленное отношение атомов C, H и O в глюкозе составляет 1:2:1, поэтому эмпирическая формула выглядит так: CH 2 O.
Проверьте свои знания
Молекула метальдегида (пестицид, используемый для улиток и slugs) содержит 8 атомов углерода, 16 атомов водорода и 4 атома кислорода. Каковы молекулярная и эмпирическая формулы метальдегида?
Ответ:
Молекулярная формула, C 8 Н 16 О 4 ; эмпирическая формула, C 2 H 4 O
Ли Кронин
Чем занимаются химики? По словам Ли Кронина ([ссылка]), химики создают очень сложные молекулы, «разбивая» маленькие молекулы и «реконструируя» их.
В выступлении на конференции TED в 2012 году Ли описывает одну увлекательную возможность: объединить коллекцию химических «чернил» с 3D-принтером, способным изготавливать реакционный аппарат (крошечные пробирки, стаканы и т. п.), чтобы создать «универсальный набор инструментов для химия.» Этот набор инструментов можно использовать для создания индивидуальных лекарств для борьбы с новой супербактерией или для «печати» лекарств, индивидуально настроенных с учетом вашей генетической структуры, окружающей среды и состояния здоровья. Кронин говорит: «То, что Apple сделала для музыки, я хотел бы сделать для открытия и распространения лекарств, отпускаемых по рецепту». 1 Полный текст его выступления можно найти на сайте TED.
Химик Ли Кронин был назван одним из 10 самых вдохновляющих ученых Великобритании.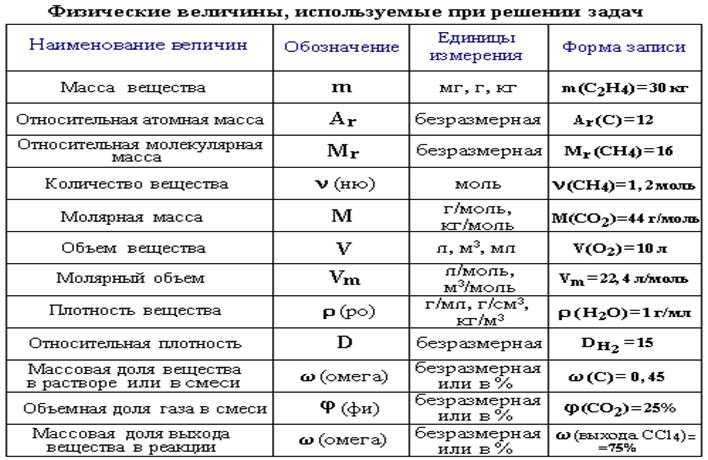
Важно знать, что одни и те же атомы могут располагаться по-разному: соединения с одной и той же молекулярной формулой могут иметь разные связи между атомами и, следовательно, разные структуры. Например, может ли существовать другое соединение с той же формулой, что и уксусная кислота, C 2 H 4 O 2 ? И если да, то какова будет структура его молекул?
Если вы предполагаете, что другое соединение с формулой C 2 H 4 O 2 может существовать, тогда вы продемонстрировали хорошее химическое понимание и правы.
Молекулы (а) уксусной кислоты и метилформиата (б) являются структурными изомерами; они имеют одинаковую формулу (C 2 H 4 O 2 ), но разные структуры (и, следовательно, разные химические свойства).
Существует множество типов изомеров ([ссылка]).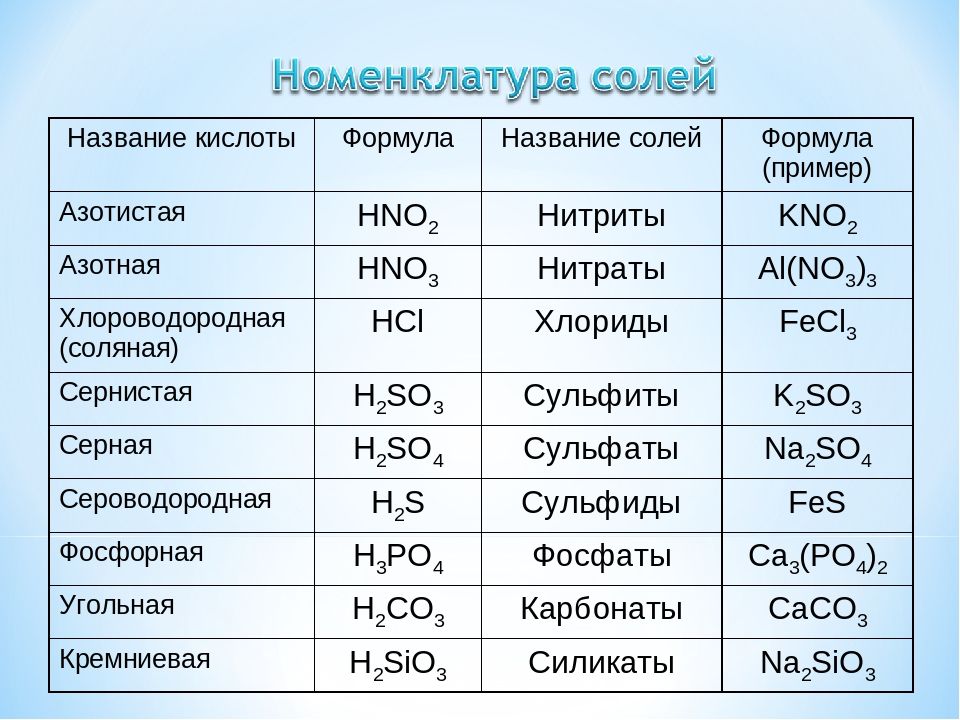
Молекулы карвона являются пространственными изомерами; они отличаются только относительной ориентацией атомов в пространстве. (кредит внизу слева: модификация работы Miansari66/Wikimedia Commons; кредит внизу справа: модификация работы Фореста и Ким Старр)
Молекулярная формула использует химические символы и нижние индексы для указания точного количества различных атомов в молекуле или соединении.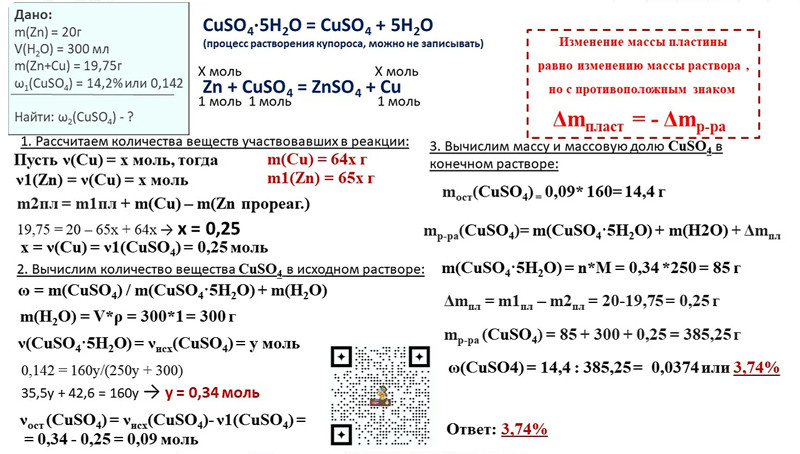
Объясните, почему символ атома кислорода и формула молекулы кислорода различаются.
Символ элемента кислорода, O, представляет как элемент, так и один атом кислорода. Молекула кислорода O 2 содержит два атома кислорода; нижний индекс 2 в формуле должен использоваться, чтобы отличить двухатомную молекулу от двух одиночных атомов кислорода.
Объясните, почему символ элемента серы отличается от формулы молекулы серы.
Напишите молекулярные и эмпирические формулы следующих соединений:
(а)
(б)
(в)
2
5
5 (а) молекулярный CO 2 , эмпирический CO 2 ; (б) молекулярный C 2 H 2 , эмпирический CH; (c) молекулярный C 2 H 4 , эмпирический CH 2 ; (d) молекулярный H 2 SO 4 , эмпирический H 2 SO 4
Напишите молекулярные и эмпирические формулы следующих соединений:
(а)
(б)
(в)
5
(г)
Определить эмпирические формулы для следующие соединения:
(a) кофеин, C 8 H 10 N 4 O 2
(b) фруктоза, C 12 3 O H 2209030 11
(в) перекись водорода, H 2 O 2
(d) глюкоза, C 6 H 12 O 6
(e) аскорбиновая кислота (витамин C), C 3 900 1 H 8 90 0 6
(а) C 4 H 5 N 2 O; (b) C 12 H 22 O 11 ; (в) НО; (г) СН 2 О; (e) C 3 H 4 O 3
Определите эмпирические формулы следующих соединений:
(a) уксусная кислота, C 2 H 4 O 2
(b) кислота лимонная, C 6 H 8 O 7
3
, N
, гидразин 4
(д ) никотин, C 10 H 14 N 2
(д) бутан, C 4 H 10
900 0 (90)002 0 (90)002 05
(б)
(а) СН 2 О; (б) С 2 H 4 O
Откройте симуляцию Build a Molecule и выберите вкладку «Larger Molecules».
а) Нарисуйте структурную формулу этой молекулы и укажите ее название.
(b) Можно ли как-нибудь расположить эти атомы, чтобы получить другое соединение?
Используйте симуляцию Build a Molecule, чтобы повторить [ссылка], но построить молекулу с двумя атомами углерода, шестью атомами водорода и одним кислородом.
а) Нарисуйте структурную формулу этой молекулы и укажите ее название.
(b) Можете ли вы расположить эти атомы так, чтобы получилась другая молекула? Если да, нарисуйте его структурную формулу и укажите название.
(c) Почему молекулы, нарисованные на рисунках (a) и (b), одинаковы? Чем они отличаются? Как они называются (тип связи между этими молекулами, а не их названия).
(a) этанол
(b) метоксиметан, более известный как диметиловый эфир
(c) Эти молекулы имеют одинаковый химический состав (типы и количество атомов), но разные химические структуры. Они являются структурными изомерами.
Воспользуйтесь симуляцией Build a Molecule, чтобы повторить [ссылка], но постройте молекулу с тремя атомами углерода, семью атомами водорода и одним атомом хлора.
а) Нарисуйте структурную формулу этой молекулы и укажите ее название.
(b) Можете ли вы расположить эти атомы так, чтобы получилась другая молекула? Если да, нарисуйте его структурную формулу и укажите название.
(c) Почему молекулы, нарисованные на рисунках (a) и (b), одинаковы? Чем они отличаются? Как они называются (тип связи между этими молекулами, а не их названия)?
Footnotes
- 1 Lee Cronin, «Print Your Own Medicine», доклад, представленный на TED Global 2012, Эдинбург, Шотландия, июнь 2012 г.
Глоссарий
- эмпирическая формула
- формула, показывающая состав соединения в виде простейшего целочисленного соотношения атомов
- изомеры
- соединений с одинаковой химической формулой, но разной структурой
- молекулярная формула
- , указывающая состав молекулы соединения и дающая фактическое число атомов каждого элемента в молекуле соединения.
Формула
- пространственные изомеры
- соединений, в которых относительная ориентация атомов в пространстве различна
- структурная формула
- показывает атомы в молекуле и то, как они связаны
- структурный изомер
- одно из двух веществ, имеющих одинаковую молекулярную формулу, но разные физические и химические свойства, поскольку их атомы связаны по-разному
2.4 Химические формулы — Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Символизируйте состав молекул, используя молекулярные формулы и эмпирические формулы
- Представьте расположение связей атомов внутри молекул, используя структурные формулы
Молекулярная формула представляет собой представление молекулы, которое использует химические символы для обозначения типов атомов, за которыми следуют нижние индексы, показывающие количество атомов каждого типа в молекуле.
Структурная формула соединения дает ту же информацию, что и его молекулярная формула (типы и количество атомов в молекуле), но также показывает, как атомы связаны в молекуле. Структурная формула метана содержит символы для одного атома С и четырех атомов Н, указывающие на число атомов в молекуле (рис. 2.16). Линии представляют собой связи, удерживающие атомы вместе. (Химическая связь — это притяжение между атомами или ионами, удерживающее их вместе в молекуле или кристалле.) Мы обсудим химические связи и увидим, как предсказать расположение атомов в молекуле позже. А пока просто знайте, что линии указывают на то, как атомы связаны в молекуле. Шарико-стержневая модель показывает геометрическое расположение атомов с размерами атомов не в масштабе, а модель заполнения пространства показывает относительные размеры атомов.
Рисунок
2.16
Молекулу метана можно представить в виде (а) молекулярной формулы, (б) структурной формулы, (в) шаростержневой модели и (г) модели заполнения пространства. Атомы углерода и водорода представлены черными и белыми сферами соответственно.
Хотя многие элементы состоят из отдельных отдельных атомов, некоторые существуют в виде молекул, состоящих из двух или более атомов элемента, химически связанных друг с другом. Например, большинство образцов элементов водорода, кислорода и азота состоят из молекул, каждая из которых содержит два атома (называемых двухатомными молекулами), и поэтому имеют молекулярные формулы H 2 , О 2 и N 2 соответственно. Другими элементами, обычно встречающимися в виде двухатомных молекул, являются фтор (F 2 ), хлор (Cl 2 ), бром (Br 2 ) и йод (I 2 ). Наиболее распространенная форма элемента серы состоит из молекул, состоящих из восьми атомов серы; его молекулярная формула S 8 (рис.
Рисунок
2.17
Молекула серы состоит из восьми атомов серы и поэтому записывается как S 8 . Его можно представить в виде (а) структурной формулы, (б) шаростержневой модели и (в) модели заполнения пространства. Атомы серы представлены желтыми сферами.
Важно отметить, что нижний индекс после символа и число перед символом не представляют одно и то же; например, H 2 и 2H представляют совершенно разные виды. H 2 представляет собой молекулярную формулу; он представляет собой двухатомную молекулу водорода, состоящую из двух атомов элемента, которые химически связаны друг с другом. Выражение 2H, с другой стороны, указывает на два отдельных атома водорода, которые не объединены в одно целое. Выражение 2H 2 представляет собой две молекулы двухатомного водорода (рис. 2.18).
Рисунок
2.18
Символы H, 2H, H 2 и 2H 2 представляют очень разные объекты.
Соединения образуются при химическом соединении двух или более элементов, что приводит к образованию связей.
Рисунок
2.19(а) Белая составная двуокись титана обеспечивает эффективную защиту от солнца. (b) Кристалл диоксида титана TiO 2 содержит титан и кислород в соотношении 1 к 2. Атомы титана окрашены в серый цвет, а атомы кислорода — в красный.
Как обсуждалось ранее, мы можем описать соединение с молекулярной формулой, в которой нижние индексы указывают фактическое количество атомов каждого элемента в молекуле сложный. Во многих случаях молекулярная формула вещества получается из экспериментального определения как его эмпирической формулы, так и его молекулярной массы (суммы атомных масс всех атомов, составляющих молекулу). Например, экспериментально можно определить, что бензол содержит два элемента, углерод (С) и водород (Н), и что на каждый атом углерода в бензоле приходится один атом водорода. Таким образом, эмпирическая формула CH. Экспериментальное определение молекулярной массы показывает, что молекула бензола содержит шесть атомов углерода и шесть атомов водорода, поэтому молекулярная формула бензола C 6 H 6 (рисунок 2.20).
Рисунок
2.20
Бензол, C 6 H 6 , производится при переработке нефти и имеет множество промышленных применений.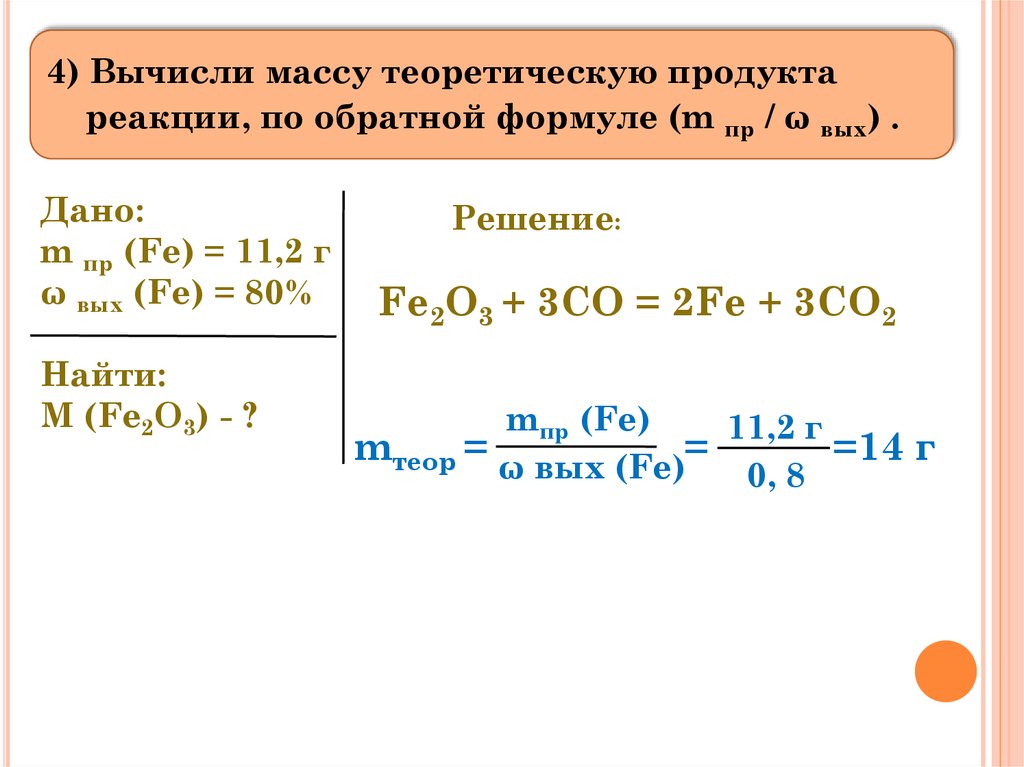
Если мы знаем формулу соединения, мы можем легко определить эмпирическую формулу. (Это своего рода академическое упражнение; на практике обычно используется обратная хронология.) Например, молекулярная формула уксусной кислоты, компонента, придающего уксусу его острый вкус, C 2 Н 4 О 2 . Эта формула показывает, что молекула уксусной кислоты (рис. 2.21) содержит два атома углерода, четыре атома водорода и два атома кислорода. Соотношение атомов 2:4:2. Деление на наименьший общий знаменатель (2) дает простейшее целочисленное соотношение атомов, 1:2:1, поэтому эмпирическая формула CH 2 O. Обратите внимание, что молекулярная формула всегда является целым числом, кратным эмпирическая формула.
Рисунок
2.21
(а) Уксус содержит уксусную кислоту, C 2 H 4 O 2 , который имеет эмпирическую формулу CH 2 O.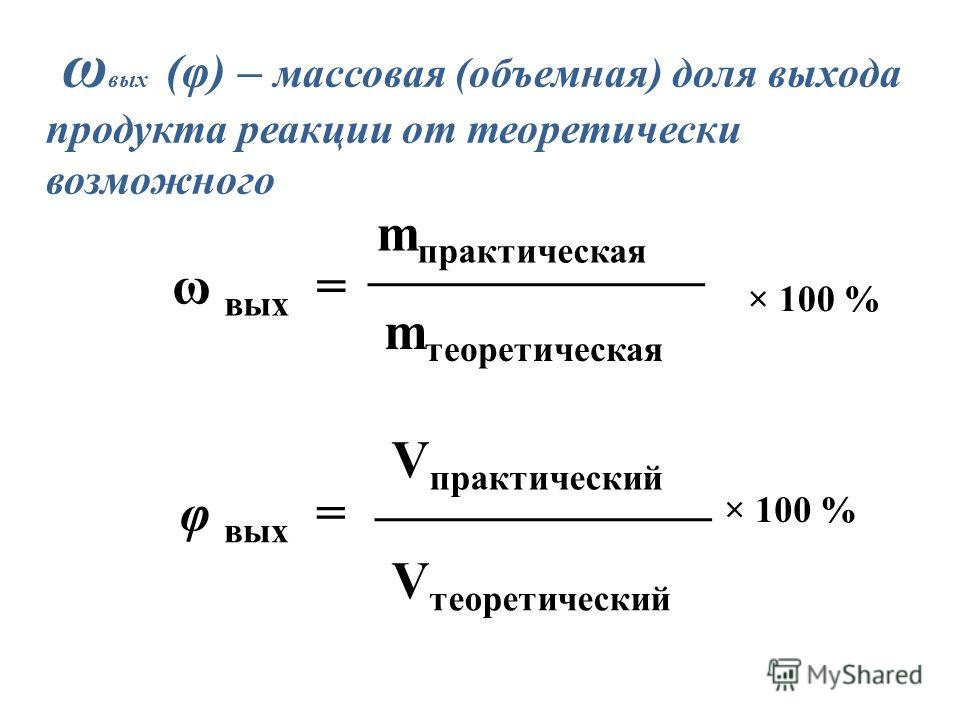
Пример
2,6
Эмпирические и молекулярные формулы
Молекулы глюкозы (сахара крови) содержат 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Каковы молекулярная и эмпирическая формулы глюкозы?
Решение
Молекулярная формула C 6 H 12 O 6 , потому что одна молекула фактически содержит 6 атомов C, 12 H и 6 атомов O. Простейшее целочисленное отношение атомов C к H к O в глюкозе составляет 1:2:1, поэтому эмпирическая формула CH 2 O.
Проверьте свои знания
Молекула метальдегида (пестицид, используемый для улиток и слизней) содержит 8 атомов углерода, 16 атомов водорода и 4 атома кислорода.
Отвечать:
Молекулярная формула, C 8 H 16 O 4 ; эмпирическая формула, C 2 H 4 O
Портрет химика
Паула Хаммонд
Вы узнали об эволюции атомной теории и начали исследовать различные химические структуры. Эти структуры приводят к тому, что молекулы притягиваются или отталкиваются друг от друга, или помогают им упорядочиваться в наших клеточных мембранах, или заставляют их либо распространяться в виде тонких пленок, либо слипаться в твердые массы.
Что эти структуры значат для ученых и для нас? По сути все. Именно структура и состав молекулы на поверхности вируса позволяет ему прикрепляться к одной из наших клеток, а структура и состав антител — веществ, созданных нашей иммунной системой, — блокируют это прикрепление. Структура хлорофилла позволяет ему использовать солнечную энергию для производства глюкозы.
Рисунок
2,22
Паула Хаммонд разработала новые методы точного определения химических структур. Работа Хаммонда применима к лечению рака, заживлению ран, лечению катаракты и топливным элементам. Широко признанный лидер в этой области, она получила множество наград и была избрана на различные престижные должности и стипендии своими коллегами и правительством США. Она возглавляет химико-технологический факультет Массачусетского технологического института, который обычно считается одним из лучших инженерных и научных институтов в мире. (кредит: модификация работы Белого дома)
Паула Хаммонд делает именно это для решения сложных проблем, начиная от рака и заканчивая потреблением энергии. Она заведует кафедрой химического машиностроения в Массачусетском технологическом институте и возглавляет исследовательскую группу, занимающуюся сборкой уникальных молекулярных структур. Они создали носители лекарств от рака — покрытия размером с наночастицы, которые позволяют лекарствам проникать в опухоли, не подвергаясь воздействию их защитных сил, — которые могут доставлять лекарства непосредственно в раковые опухоли.
Хотя исследовательская группа Хаммонд состоит из признанных и ведущих экспертов, таких как она сама, студенты, безусловно, играют определенную роль. Исследовательские лаборатории колледжей, как правило, полны докторов наук, аспирантов и даже студентов, которые участвуют в работе. Таким образом, химики и инженеры-химики, которые используют свои знания для решения проблем, также поддерживают новое поколение создателей и решателей проблем.
Важно знать, что одни и те же атомы могут располагаться по-разному: соединения с одинаковой молекулярной формулой могут иметь разные связи между атомами и, следовательно, разные структуры.
Если вы предполагаете, что может существовать другое соединение с формулой C 2 H 4 O 2 , то вы продемонстрировали хорошее химическое понимание и правы. Два атома C, четыре атома H и два атома O также могут образовывать метилформиат, который используется в производстве в качестве инсектицида и для быстросохнущих покрытий. Молекулы метилформиата имеют один из атомов кислорода между двумя атомами углерода, что отличается от расположения в молекулах уксусной кислоты. Примерами изомеров являются уксусная кислота и метилформиат — соединения с одинаковой химической формулой, но разной молекулярной структурой (рис. 2.23). Обратите внимание, что это небольшое различие в расположении атомов оказывает большое влияние на их соответствующие химические свойства. Вы, конечно, не захотите использовать раствор метилформиата вместо раствора уксусной кислоты (уксуса), когда делаете заправку для салата.



 Определить ключевой компонент:
Определить ключевой компонент:


Добавить комментарий