Содержание
Гидролиз солей азотной и азотистой кислот. Задачи 901
Гидролиз солей
Задача 901.
Какова реакция среды в растворах NaNO3, NH4NO3, NaNO2, NH4NO2? Какие из перечисленных солей взаимодействуют в подкисленном серной кислотой растворе: а) с йодидом калия; б) с перманганатом калия? Написать уравнения протекающих реакций.
Решение:
I Гидролиз солей.
а) NaNO3 – соль сильного основания и сильной кислоты в водных растворах не гидролизуется поэтому реакция среды нейтральная, рН = 7.
б) NH4NO3 – соль сильной кислоты и слабого основания, гидролизуется по катиону, так как ион NH4+ с ионом ОН– с образованием слабого электролита:
NH4NO3 ↔ NH4+ + OH–;
NH4+ + H2O ↔ NH4OH + H+.
Образовавшийся избыток ионов Н+ придаёт раствору кислую среду, рН < 7.
в) NaNO2 – соль сильного основания и слабой кислоты, гидролизуется по аниону, так как ионы NO2– связываются с ионами Н+ воды с образованием слабого электролита HNO2:
NO2– + Н2О ↔ НNO2 + ОН–
Образовавшийся избыток ОН– — ионов придаёт раствору щелочную среду, рН > 7.
г) NH4NO2 – соль слабого основания и слабой кислоты, поэтому гидролизуется как по катиону, так и по аниону, потому что ионы NH4+ связываются с ионами ОН– с образованием слабого электролита NH4OH, а ионы NO2– связываются с ионами Н+ с образованием слабого электролита НNO2:
NH4NO2 ↔ NH4+ + NO2–;
NH4+ + H2O ↔ NH4OH + H+;
NO2– + Н2О ? НNO2 + ОН–.
Образовавшиеся в избытке ионы Н+ и ОН– связываются с друг с другом с образованием Н2О, что придаёт раствору нейтральную среду, рН = 7. Но фактически гидролиз данной соли протекает не равномерно, наблюдается избыток ионов Н+, рН < 7. Объясняется это тем, что константа диссоциации NH4OH гораздо меньше, чем константа диссоциации НNO2 [KD(NH4OH) = 1,8 . 10-5; КD(НNO2) = 4 . 10-4]. Поэтому гидролиз соли будет с незначительным преимуществом протекать по катиону, т. е. в растворе будет наблюдаться некоторый избыток ионов Н+, что и будет придавать ему слабо-кислую среду, рН 7.
II Реакции NaNO3, NH4NO3, NaNO2, NH4NO2 с йодидом калия и перманганатом калия.
В NaNO3 азот находится в своей высшей степени окисления +5, поэтому NaNO3 как окислитель не будет вступать в реакции окисления-восстановления с окислителем KMNO4, а будет вступать в реакцию с восстановителем KI.
2NaNO3 + 2КI + 2H2SO4 = I2 + 2NO2↑ + Na2SO4 + K2SO4 + 2H2O
2Nh5NO3 + 2КI + 2H2SO4 = I2 + 2NO2↑ + (NH4)2SO4 + K2SO4 + 2H2O
В NaNO2 и NH4NO2 атом азота в ионе NO2– находится в своей промежуточной степени окисления +3.
а) 2NaNO2 + 2КI + 2H2SO4 = I2 + 2NO↑ + Na2SO4 + K2SO4 + 2H2O;
2Nh5NO2 + 2КI + 2h3SO4 = I2 + 2NO?+ (Nh5)2SO4 + K2SO4 + 2H2O.
б) 5NaNO2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + K2SO4 + 5NaNO3 + 3H2O;
5NH4NO2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + K2SO4 + 5NH4NO3 + 3H2O.
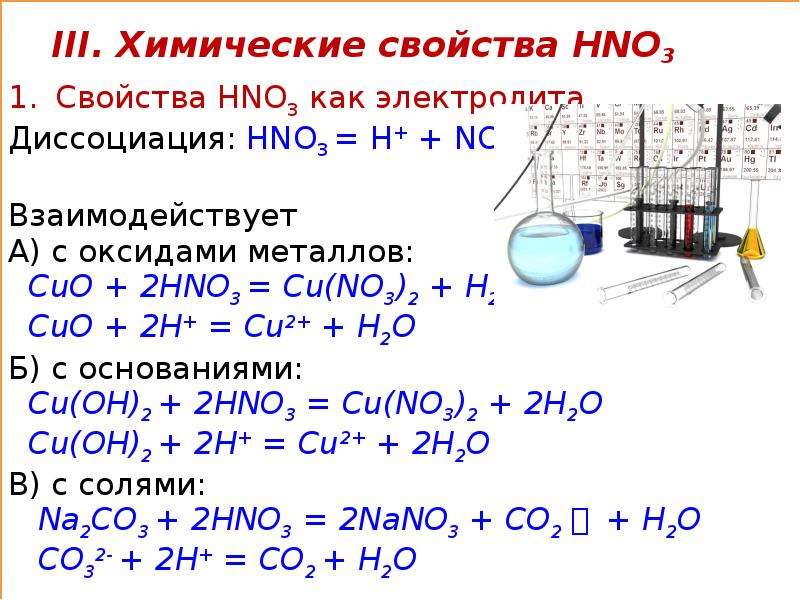
Химические свойства азотной кислоты
Задача 902. Написать уравнения взаимодействия азотной кислоты с цинком, ртутью, магнием, медью, серой, углем, йодом. От чего зависит состав продуктов восстановления азотной кислоты?
Решение:
Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые в оксиды.
Состав продуктов восстановления металлов зависит от природы восстановителя (металла) и от условий реакции, прежде всего концентрации кислоты. Чем выше концентрация азотной кислоты, тем менее глубоко она восстанавливается. При реакциях с концентрированной азотной кислотой чаще всего выделяется NO2. При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например, с медью выделяется NO. При взаимодействии разбавленной азотной кислоты с более активными металлами – цинк, железо – образуется N2O. Сильно разбавленная азотная кислота взаимодействует с активными металлами — цинком, магнием, алюминием – с образованием иона аммония NH4+, дающего с кислотой нитрат аммония NH4NO3. При действии азотной кислоты на металлы водород не выделяется.
При окислении неметаллов концентрированная азотная кислота, как и в случае с металлами, восстанавливается до NO2.
Более разбавленная азотная кислота обычно восстанавливается до NO.
Уравнения реакций азотной кислоты с металлами и неметаллами:
а) 4Zn + 10HNO3(конц.) ↔ 4Zn(NO3)2 + N2O↑+ 5H2O;
5Zn + 12HNO3(разб.) ↔ 5Zn(NO3)2 + N2↑ + 6H2O;
4Zn + 10HNO3(очень разб.) ↔ 4Zn(NO3)2 + NH4NO3 + 3H2O.
б) Hg + 4HNO3(конц.) ↔ Hg(NO3)2 + 2NO2↑ + 2H2O;
3Hg + 8HNO3(разб.) ↔ 3Hg(NO3)2 + 2NO↑+ 4H2O;
4Hg + 10HNO3(очень разб.) ↔ 4Hg(NO3)2 + N2O + 5H2O.
в) 4Mg + 10HNO3(конц.) ↔ 4Mg(NO3)2 + N2O↑+ 5H2O;
5Mg + 12HNO3(разб.) ↔ 5Mg(NO3)2 + N2↑ + 6H2O;
4Mg + 10HNO3(очень разб.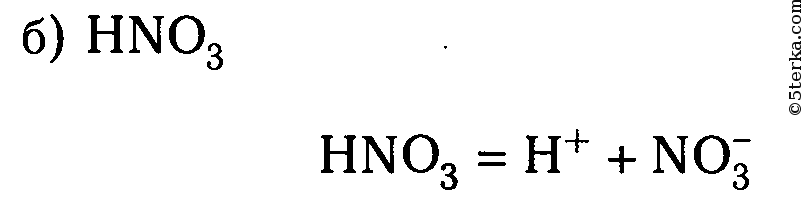
г) Cu + 4HNO3(конц.) ↔ Cu(NO3)2 + 2NO2↑ + 2H2O;
3Cu + 8HNO3(разб.) ↔ 3Cu(NO3)2 + 2NO↑ + 4H2O;
4Cu + 10HNO3(очень разб.) ↔ 4Cu(NO3)2 + N2O + 5H2O.
д) S + 6HNO3(конц.) ↔ H2SO4 + 6NO2↑ + 2H2O;
S + 2HNO3(разб.) ↔ H2SO4 + 2NO↑.
e) C + 4HNO3(конц.) ↔ CO2↑+ 4NO2↑ + 2H2O;
3C + 4HNO3(разб.) ↔ 3CO2↑ + 4NO↑ + 2H2O.
ж) I2 + 2HNO3(конц.) ↔ 2HIO + 2NO2↑;
3I2 + 2HNO3(разб.) + 2H2O ↔ 6HIO + 2NO↑.
Реакция диспропорционирования азотистой кислоты
Задача 903.
Написать уравнение реакции диспропорционирования НNO2.
Решение:
Формула азотистой кислоты имеет вид: HNO2. Азот в азотистой кислоте находится в своей промежуточной степени окисления +3, т. е. из возможных значений для азота. Поэтому HNO2 проявляет окислительно-восстановительную двойственность, для неё характерно внутримолекулярное самоокисление-самовосстановление. В определённых условиях азотистая кислота претерпевает процесс, в ходе которого одна часть азота окисляется, а другая – восстанавливается. Этот процесс называется самоокислением-самовосстановлением. Самоокислением-самовосстановлением называют также диспропорционированием. Так, в ходе термической диссоциации HNO2 образуются два оксида азота NO и NO2, в которых атомы азота проявляют соответственно степень окисления +2 и +4, т. е. часть атомов азота окисляется, степень окисления атома возрастает от +3 до +4), а другая часть — восстанавливается, степень окисления атома уменьшается от +3 до +2:
Копилка знаний.

Примеры рассуждений при выполнении упражнений
Рассмотрим примеры заданий по составлению уравнение диссоциации.
Задание 1. Составьте уравнение диссоциации азотной кислоты
Решение
1. Запишите формулу вещества, определите его класс и
способность диссоциировать, т е сильный это электролит или слабый
НNO3
кислота сильный электролит (это надо знать наизусть),
следовательно, диссоциирует необратимо в одну стадию.
2. Запишите уравнение(я) диссоциации по изученным правилам.
НNO3
=
H+ + NO3—
Задание 2 Составьте уравнение
диссоциации фосфорной кислоты. Решение
1.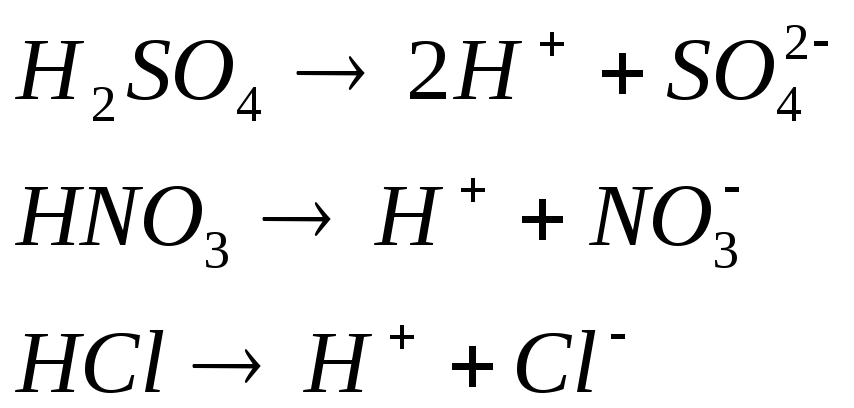
способность диссоциировать, т. е. сильный это электролит или слабый.
Н3PO4
— кислота — слабый электролит (это надо знать наизусть), следовательно,
диссоциирует обратимо в три стадии, так как в молекуле имеется З атома
водорода.
2. Запишите уравнение(я) диссоциации по изученным правилам. (смотрите видео ролик)
Задание 3. Составьте уравнение
диссоциации гидроксида бария. Ва(ОН)2
Решение
1. Запишите формулу вещества, определите его класс и
способность диссоциировать, т е сильный это электролит или слабый
Ва(ОН)2 — основание В таблице растворимости ему
соответствует буква значит, растворимое, следовательно, сильный электролит,
поэтому уравнение диссоциации можно записать в одну стадию и необратимо.
2. Запишите уравнение(я) диссоциации по изученным правилам.
II I
Ba(OH)2 = Ba2+ + 2OH—
Задание 4. Составьте уравнение диссоциации гидроксида алюминия.
Аl(ОН)3
Решение
1. Запишите формулу вещества, определите его класс и
способность диссоциировать, т. е. сильный это электролит или слабый.
Аl(ОН)3
— основание. В таблице растворимости ему соответствует буква (<Н)>,
значит, нерастворимое, слабый электролит, поэтому уравнение диссоциации
необходимо записать в три стадии и обратимо.
2. Запишите уравнение(я) диссоциации по изученным правилам.(смотрите видео ролик)
Задание 5. Составьте уравнение диссоциации сульфата желе за
(ΙII).
Решение
1.. Запишите формулу вещества, определите его класс и
способность диссоциировать, т. е. сильный это электролит или слабый.
Fe2(SO4)3 — соль. В таблице растворимости ей
соответствует буква «Р», значит, растворимое, следовательно, сильный электролит,
поэтому уравнение диссоциации надо записать в одну стадию и необратимо.
2. Запишите уравнение(я) диссоциации по изученным правилам.
III II
Fe2(SO4)3 = 2Fe3+ +3SO42-
Задание 6.
Решение
- Запишите формулу вещества,
определите его класс и способность диссоциировать, т. е. сильный это
электролит или слабый. - СаСО3 — соль В
таблице растворимости ей соответствует буква с «Н» значит, нерастворимое,
следовательно, слабый электролит, поэтому уравнение диссоциации надо
записать в одну стадию и обратимо Запишите уравнение(я) диссоциации по изученным
правилам(смотрите видео ролик)
Степенью
электролитической диссоциации
называют
отношение числа моль электролита, распавшегося на ионы к общему числу моль электролита в растворе
Степень диссоциации выражают в долях единицы процентах.
Физический смысл этой величины заключается том, что она показывает долю электролита,
распавшегося на ионы.
Для веществ молекулярного строения (например, органических
или неорганических
кислот) степень диссоции можно выразить через число молекул
электролита:
Видео с вопросами: определение химического уравнения ионизации азотной кислоты
Стенограмма видео
В растворе азотной кислоты HNO3,
полностью ионизируется с образованием кислого раствора.
показывает ионизацию HNO3? (A) Водный раствор HNO3 плюс водный раствор H+
реагируют с образованием водного раствора h3NO3. (B) Водный раствор HNO3 реагирует с образованием H+
водный плюс NO3− водный. (C) Водный раствор HNO3 реагирует с образованием NO2
водный плюс ОН- водный. (D) Водный раствор HNO3 реагирует с образованием
HNO2 водный плюс O- водный. (E) Два водных раствора HNO3 реагируют с образованием
два водных раствора H+ плюс газообразный N2 плюс три газообразных O2.
В этом вопросе нам говорят, что
когда азотная кислота образует кислый раствор, она полностью ионизируется. Глядя на варианты ответов,
мы видим, что за химической формулой азотной кислоты стоит символ состояния
водный Напомним, что aq является государственным символом
что представляет собой водный раствор. Водный раствор содержит один или
больше растворенных веществ, растворенных в воде.
кислота HNO3.
Когда кислота растворяется в воде,
говорят, что это кислый раствор. Некоторые кислоты, такие как азотная кислота,
полностью ионизируются при растворении в воде. Это означает, что в течение
В процессе растворения все молекулы HNO3 диссоциируют на отдельные ионы. Чтобы помочь нам решить проблему, давайте
создайте основное уравнение для представления ионизации HNO3. Мы знаем, что азотная кислота ионизирует
при растворении в растворе. В химических уравнениях, представляющих
ионизация, вода обычно включается в качестве реагента или пишется над реакцией
стрелка. Однако в вариантах ответа aq
вместо этого используется раствор, содержащий воду.
Напишем химическую формулу
HNO3, за которым следует символ состояния aq, обозначающий реагент нашей ионизации.
уравнение.
уравнением будут растворенные ионы. Один из этих ионов, ион А, будет иметь
положительный заряд, а другой ион, ион B, будет иметь отрицательный заряд. Итак, какие ионы будет производить HNO3
при растворении в воде? Согласно теории Аррениуса,
Кислота – это вещество, которое образует или увеличивает количество ионов Н+ при растворении в воде. А по Бренстеду-Лоури
Теоретически кислота – это вещество, отдающее ион H+ в ходе реакции.
Если бы мы написали уравнение для
ионизации HNO3 по определению Аррениуса, один из образующихся ионов является
ион Н+. Если бы мы написали уравнение, используя
Согласно теории Бренстеда-Лоури, вместо этого одним из образующихся ионов является ион h4O+. Согласно этой теории, азотная
молекула кислоты отдает ион водорода молекуле воды, образуя ион h4O+.
При сканировании вариантов ответа,
мы замечаем, что ни один из них не включает воду в качестве реагента или h4O+ в качестве продукта.
уравнение, которое мы написали, чтобы помочь нам выбрать правильный вариант ответа.
Начнем с ответа
выбор (А). В этом уравнении азотная кислота
реагирует с ионом Н+. Однако мы знаем, что во время
В процессе ионизации кислота образует ионы Н+. Мы также замечаем, что ионы не появляются
вообще в правой части уравнения. h3NO3 не имеет заряда, поэтому
представляет собой нейтральную молекулу. По этим причинам мы можем исключить
выбор ответа (А).
Теперь давайте посмотрим на варианты ответов
(С) и (Г). При выборе ответа (С) продукты
являются NO2, нейтральная молекула, и ион OH-. Поскольку ион OH- образуется
вместо иона Н+ и образуется только один ион, вариант ответа (С) неверен
выбор ответа. При выборе ответа (D) продукты
образуются HNO2, нейтральная молекула, и ион O–.
уравнение действительно не включает H+ как продукт, а также не показывает два иона
образуется в процессе ионизации. Таким образом, мы можем исключить выбор ответа
(Д).
Остаются только варианты ответа (B)
и (Е). Оба варианта ответа
включают ион H+ в качестве продукта. При выборе ответа (Б) второй
произведение – ион. А в варианте ответа (Е) есть
два дополнительных продукта, газообразный азот и газообразный кислород, которые оба состоят из
нейтральные молекулы. Мы знаем, что когда кислота ионизируется,
один из ионов является ионом Н+, а второй ион является противоположно заряженным ионом. Хотя вариант ответа (E) делает
включают ион H+ как продукт, он не включает отрицательный ион, который также
формы. По этой причине мы можем исключить
выбор ответа (Е). 9
Ответ
Проверено
220,8 тыс.
Подсказка: Нам нужно помнить, что кислота может окрашивать лакмус в красный цвет и реагировать с основанием, образуя водный раствор, тогда как основание окрашивает лакмус в красный цвет и аналогично реагирует с кислотой на производят водный раствор. Мы также помним, что \[HN{O_3}\] — это азотная кислота, которая обычно является слабой кислотой.
Полный пошаговый ответ:
Прежде чем решать этот вопрос, давайте проведем сравнительное исследование кислоты и основания. 9- \] ионов, а константа ионизации представлена как диссоциация ионов, деленная на концентрацию \[HN{O_3}\].
Вариант B) Это неправильный вариант, как описано выше.
Вариант C) это неправильный вариант, так как он не представляет константу ионизации кислоты.
Вариант D) это неправильный вариант, так как мы получили правильный ответ.
Следовательно, правильный ответ: «Вариант А».
Примечание: Мы должны помнить, что сопряженная кислота представляет собой вид, который образуется, когда кислота отдает \[{H^ + }\] основанию, или вы можете называть его основанием, на котором присоединяется протон.

Добавить комментарий