Содержание
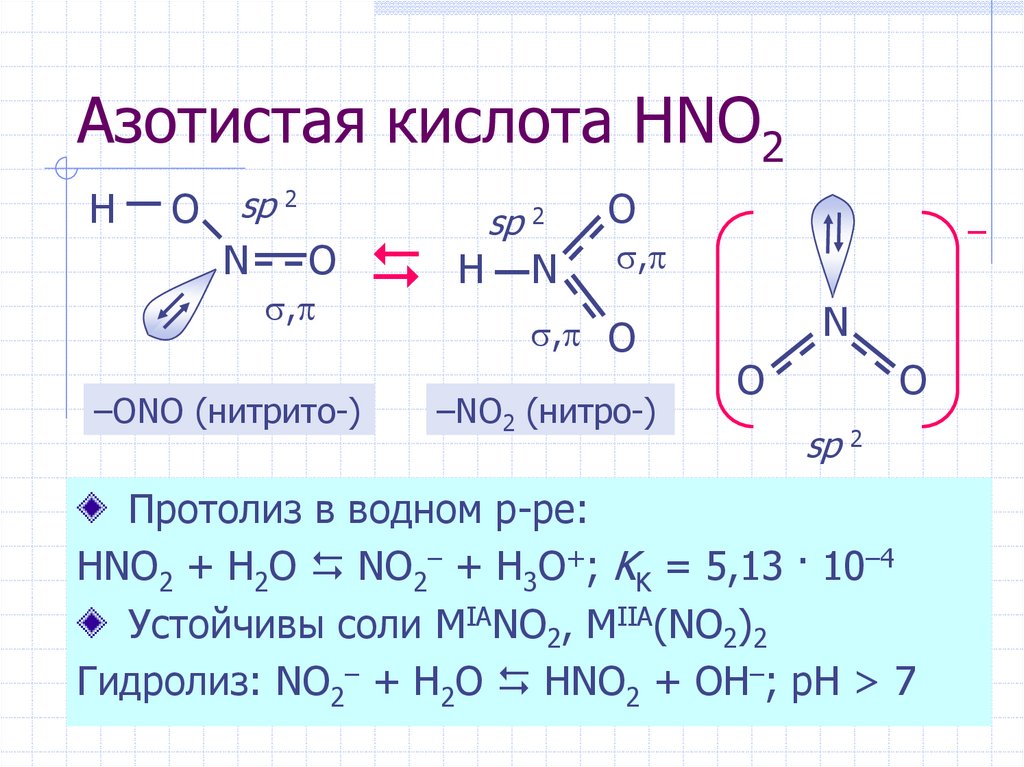
Азотистая кислота: получение и свойства
Азотистая кислота HNO2— слабая, одноосновная, химически неустойчивая кислота.
Получение азотистой кислоты
Азотистую кислоту легко получить вытеснением из нитритов более сильной кислотой.
Например, соляная кислота вытесняет азотистую кислоту из нитрита серебра:
AgNO2 + HCl → HNO2 + AgCl
Химические свойства
1. Азотистая кислота HNO2 существует только в разбавленных растворах, при нагревании она разлагается:
3HNO2 → HNO3 + 2NO + H2O
без нагревания азотистая кислота также разлагается:
2HNO2 → NO2 + NO + H2O
2. Азотистая кислота взаимодействует с сильными основаниями.
Например, с гидроксидом натрия:
HNO2 + NaOH → NaNO2 + H2O
3. За счет азота в степени окисления +3 азотистая кислота проявляет слабые окислительные свойства. Окислительные свойства HNO2 проявляет только при взаимодействии с сильными восстановителями.
Например, HNO2 окисляет иодоводород:
2HNO2 + 2HI → 2NO + I2 + 2H2O
Азотистая кислота также окисляет иодиды в кислой среде:
2НNO2 + 2KI + 2H2SO4 → K2SO4 + I2 + 2NO + 2H2O
Азотистая кислота окисляет соединения железа (II):
2HNO2 + 3H2SO4 + 6FeSO4 → 3Fe2(SO4)3 + N2 + 4H2O
4.
Например, хлор окисляет азотистую кислоту до азотной кислоты:
HNO2 + Cl2 + H2O → HNO3 + 2HCl
Кислород и пероксид водорода также окисляют азотистую кислоту:
2HNO2 + O2 → 2HNO3
HNO2 + H2O2 → HNO3 + H2O
Соединения марганца (VII) окисляют HNO2:
5HNO2 + 2HMnO4 → 2Mn(NO3)2 + HNO3 + 3H2O
Понравилось это:
Нравится Загрузка.
Азотистая кислота | это… Что такое Азотистая кислота?
Азо́тистая кислота HNO2 — слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Соли азотистой кислоты называются нитритами или азотистокислыми. Нитриты гораздо более устойчивы, чем HNO2, все они токсичны.
Содержание
|
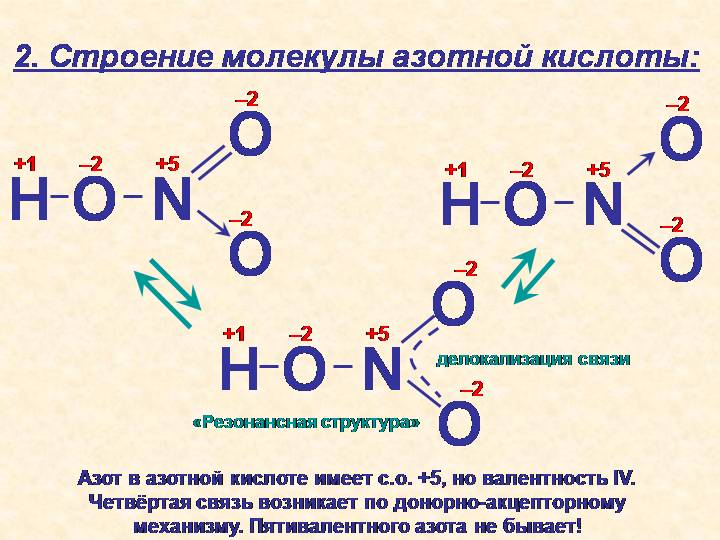
Строение
В газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций цис- и транс-. При комнатной температуре преобладает транс-изомер.
|
|
|
|
|
|
Вторая структура является более устойчивой.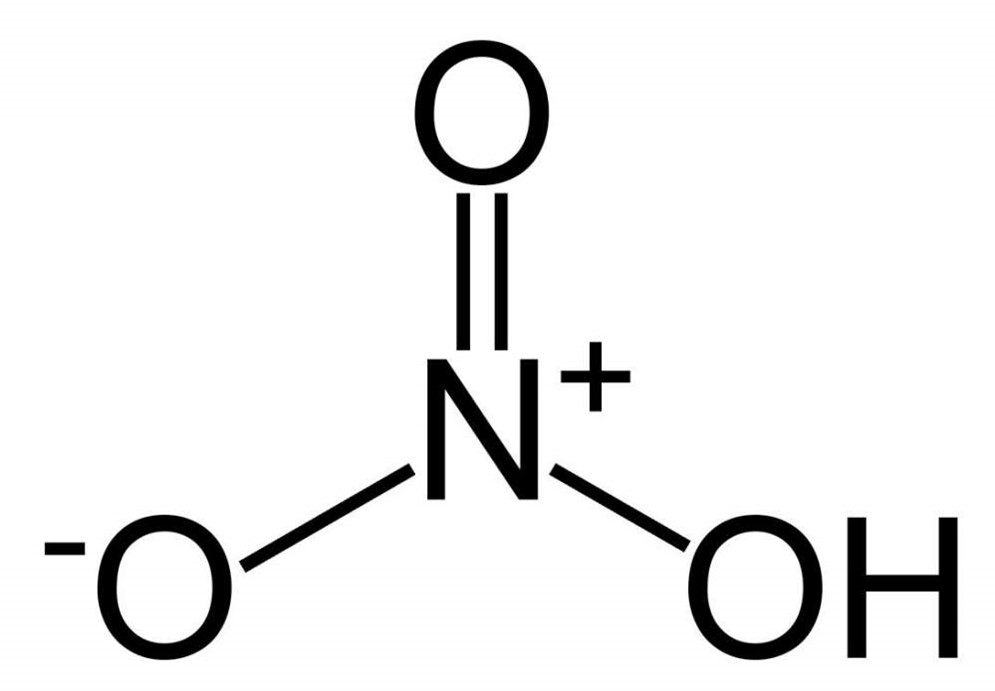
Химические свойства
В водных растворах существует равновесие:
При нагревании раствора азотистая кислота распадается с выделением NO и образованием азотной кислоты:
HNO2 является слабой кислотой. В водных растворах диссоциирует (KD=4,6·10−4), немного сильнее уксусной кислоты. Легко вытесняется более сильными кислотами из солей:
Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (пероксид водорода, хлор, перманганат калия) окисляется в азотную кислоту:
В то же время она способна окислять вещества, обладающие восстановительными свойствами:
Получение
Азотистую кислоту можно получить при растворении оксида азота (III) N2O3 в воде:
Также она получается при растворении в воде оксида азота (IV) NO2:
Применение
Азотистая кислота применяется для диазотирования первичных ароматических аминов и образования солей диазония.
Физиологическое действие
Азотистая кислота токсична, причём обладает ярко выраженным мутагенным действием, поскольку является деаминирующим агентом.
Источники
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. М.: Химия1994
Ссылки
- Азотистая кислота // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
Растворимость кислот, оснований и солей в воде
| H+ | Li+ | K+ | Na+ | NH4+ | Ba2+ | Ca2+ | Mg2+ | Sr2+ | Al3+ | Cr3+ | Fe2+ | Fe3+ | Ni2+ | Co2+ | Mn2+ | Zn2+ | Ag+ | Hg2+ | Hg22+ | Pb2+ | Sn2+ | Cu+ | Cu2+ | |
| OH− | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F− | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I− | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO32− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO42− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2− | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO43− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO32− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO− | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN− | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO32− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Азотистая кислота | химическое соединение
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы. - Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории.
- Студенческий портал
Britannica — это главный ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и т. д. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю. - Спасение Земли
Британника представляет список дел Земли на 21 век. Узнайте об основных экологических проблемах, стоящих перед нашей планетой, и о том, что с ними можно сделать! - SpaceNext50
Britannica представляет SpaceNext50. От полета на Луну до управления космосом — мы изучаем широкий спектр тем, которые питают наше любопытство к космосу!
Содержание
-
Введение
Краткие факты
-
Связанный контент
Азотистая кислота — формула, структура, свойства и применение
- Химия
- Азотистая кислота
Дата последнего обновления: 18 апреля 2023
Всего: 2k 105 •
просмотров
3
•
Просмотров сегодня: 8.
Что такое азотистая кислота?
Говоря о кислотах, вы часто будете слышать название кислоты HNO2. HNO2 также известна как азотистая кислота и представляет собой кислое соединение, нестабильное и слабое. Он готовится только в разбавленных формах и обычно холодный. Это очень полезное соединение для превращения некоторых аминов в соединения диазония. Вопрос, который вы могли бы задать в первую очередь: «Какова формула азотистой кислоты?» Формула азотистой кислоты в химии – HNO2. Его молярная масса составляет 47,013 г/моль. Плоская молекула означает, что атом азота связан с атомами кислорода через одинарные и двойные связи. Обе эти молекулы кислорода являются электроотрицательными по своей природе. Ниже показана структура азотистой кислоты HNO2:
[Изображение скоро будет загружено]
Азотистая кислота имеет свойство взрываться при контакте с некоторыми соединениями, такими как трихлорид фосфора. Считается сильным окислителем.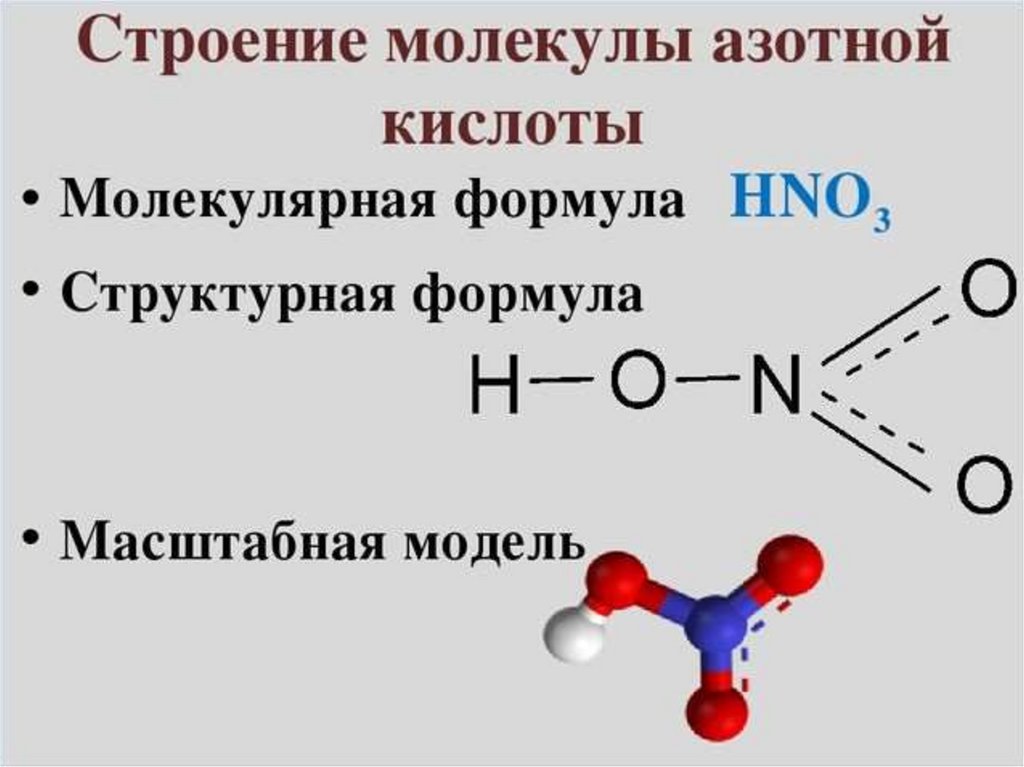
Физические свойства азотистой кислоты HNO2
Жидкая форма: Азотистая кислота доступна только в жидкой форме – либо растворенной в воде, либо в виде азотнокислой соли.
Бледно-голубой: раствор азотистой кислоты имеет бледно-голубой цвет и получает свой цвет от N2O3, который представляет собой синее твердое вещество и имеет кислотную природу.
Плотность: Азотистая кислота HNO2 имеет плотность около 1 г/мл при весе около 47,013 г/моль
Температура кипения: Температура кипения азотистой кислоты составляет 158 градусов по Цельсию.
Химические свойства азотистой кислоты HNO2
Одноосновная кислота: Поскольку азотистая кислота HNO2 имеет только один ион водорода, который она может передать основанию в случае реакции между кислотой и основанием, она известна как одноосновная кислота.
Нестабильный: Азотистая кислота крайне нестабильна по своей природе, поэтому в основном встречается в жидкой форме. Его нужно каждый раз готовить заново.
Слабая кислота: Азотистая кислота является слабой кислотой и поэтому не полностью диссоциирует в воде.
Степень окисления: Поскольку степень окисления N в HNO2 равна 3+, он может действовать как окислитель, так и восстановитель.
Азотистая кислота окисляет сероводород с образованием серы:
h3S+2HNO2→2h3O+2NO+S
Реакция с основаниями: Поскольку азотистая кислота по своей природе является кислой, она реагирует с основаниями с образованием солей. Он обычно образует нитритные соли, такие как нитрит натрия.
2 HNO2 + Na2CO3 → 2 NaNO2 + HCO3
Структура азотистой кислоты
Формула азотистой кислоты представлена HNO2.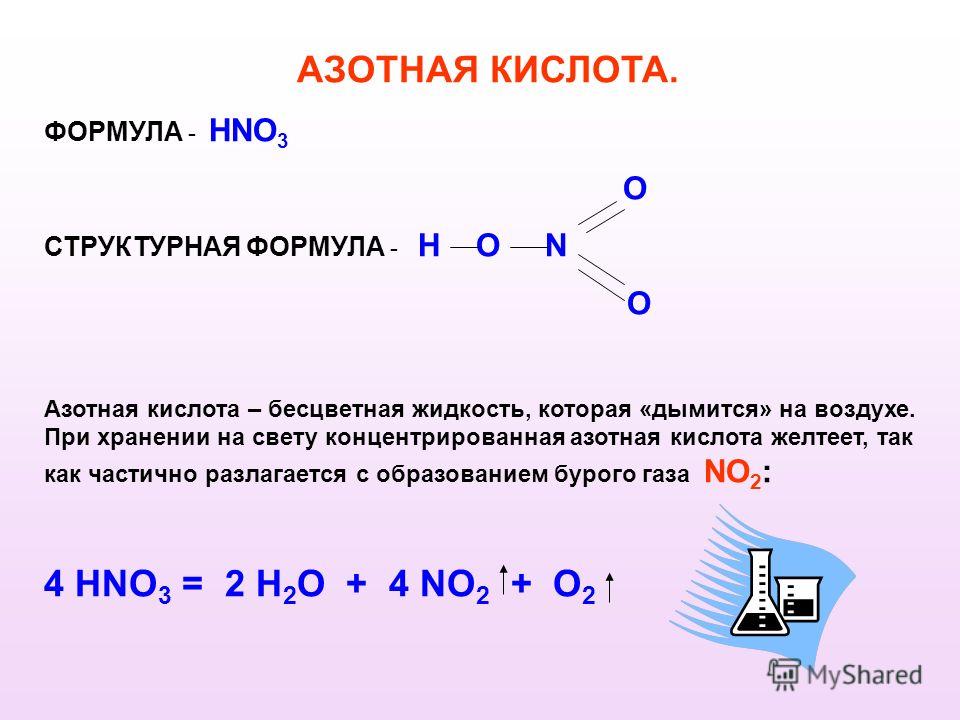
[Изображение будет загружено в ближайшее время]
Использование азотистой кислоты
Азотистая кислота является полезным соединением в нескольких отраслях промышленности и лабораториях органической химии для производства других химических веществ. Например, реакция азотистой кислоты с амином может привести к образованию солей диазония. Когда амин 1 степени реагирует с азотистой кислотой, он дает нам хлорид алкилдиазония.

Добавить комментарий