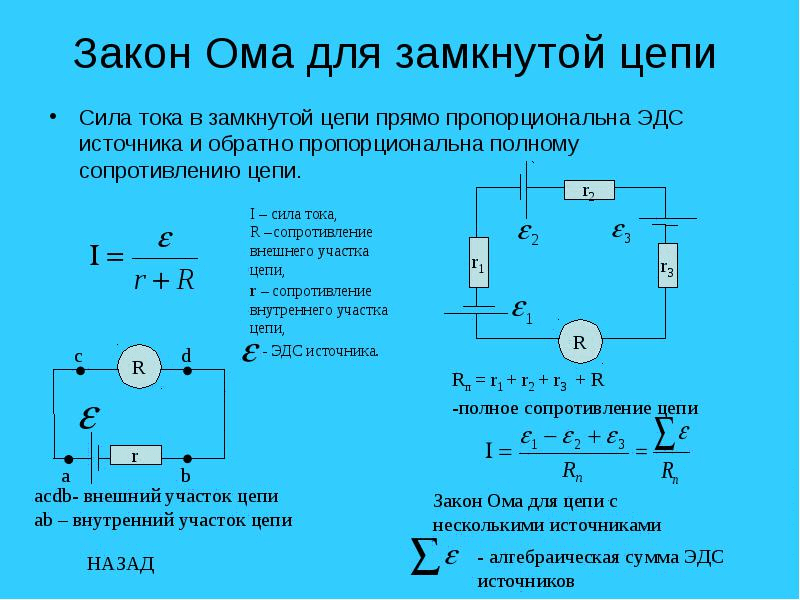
Содержание
Электрический ток.Источники электрического тока. Электрический ток в металлах 8 класс
Курсы для аттестации учителей от 800 ₽ (72 часа). Документы об окончании по почте БЕСПЛАТНО…
СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Выбрать материалы
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока
Тест по физике Электрический ток. Источники электрического тока. Электрический ток в металлах для учащихся 8 класса с ответами. Тест состоит из 10 заданий и предназначен для проверки знаний к главе Электрические явления.
Вопрос 1
Электрическим током называют
Варианты ответов
- направленное движение частиц
- направленное движение заряженных частиц
- движение заряженных частиц
- направленное движение электронов
Вопрос 2
Чтобы в проводнике возник электрический ток, необходимо
Варианты ответов
- действие на электроны сил, вызывающих их движение
- наэлектризовать проводник
- создание в проводнике электрического поля
Вопрос 3
Полюсы источника тока — это место, где
Варианты ответов
- накапливаются электрические заряды разного знака
- электрические заряды взаимодействуют
- разделяются электрические заряды
Вопрос 4
Какая энергия необходима для разделения в источнике тока электрических зарядов?
Варианты ответов
- Механическая
- Химическая
- Внутренняя
- Любая из перечисленных или другой вид энергии
Вопрос 5
Что в гальваническом элементе служит положительным электродом, что — отрицательным?
Варианты ответов
- Положительным — угольный стержень, отрицательным — слой смолы
- Положительным — угольный стержень, отрицательным — клейстер
- Положительным — слой смолы, отрицательным — цинковый сосуд
- Положительным — угольный стержень, отрицательным — цинковый сосуд
Вопрос 6
Аккумулятор дает электрический ток только после того, как
Варианты ответов
- его согрели в теплом помещении
- его зарядили от другого источника тока
- наэлектризовали его электроды
Вопрос 7
Какие еще (кроме свободных электронов) заряженные частицы имеются в металлах? Где они находятся?
Варианты ответов
- Положительные ионы; на постоянном для каждого месте
- Положительные ионы; в узлах кристаллической решетки
- Атомы; в узлах кристаллической решетки
- Отрицательные ионы; каждый на определенном месте
Вопрос 8
Какое движение и каких частиц представляет собой электрический ток в металлах?
Варианты ответов
- Упорядоченное (однонаправленное) движение свободных электронов
- Согласованное колебание ионов в узлах кристаллической решетки
- Упорядоченное смещение положительных ионов
Вопрос 9
Кристаллическая решетка металла, образуемая ионами, имеет положительный заряд.
Варианты ответов
- Потому что свободные электроны в металле, двигаясь хаотично, попадают на поверхность и экранируют положительный заряд решетки
- Потому что ионы сохраняют свое местоположение в твердом теле
- Потому что общий отрицательный заряд всех свободных электронов равен всему положительному заряду ионов
- Среди ответов нет правильного
Вопрос 10
При каком условии в металлическом проводнике возникает электрический ток?
Варианты ответов
- В случае перехода хаотического движения свободных электронов в упорядоченное движение
- При создании в нем электрического поля
- При появлении в нем свободных электронов
- В случае включения его в электрическую цепь
Пройти тест
Сохранить у себя:
© 2023,
Дудник Татьяна Викторовна
61
Тест: Электрический ток
Тест «Электрический ток» поможет не только вспомнить школьный материал по урокам физики, но и повысить личный уровень владения данной темой.
Начало теста
1 вопрос
Электрическим ток – это…
Варианты ответов:
- движение заряженных частиц
- направленное движение заряженных частиц
- направленное движение электронов
2 вопрос
Каково назначение источника тока?
Варианты ответов:
- Создавать электрические заряды в проводнике
- Освобождать электроны в проводнике от связи с атомами
- Поддерживать существование в проводнике электрического поля
3 вопрос
Что необходимо, чтобы в проводнике возник электрический ток?
Варианты ответов:
- наэлектризовать проводник
- действие на электроны сил, вызывающих их движение
- создание в проводнике электрического поля
4 вопрос
Полюсы источника тока — это …
Варианты ответов:
- место, где накапливаются электрические заряды разного знака
- место, где электрические заряды взаимодействуют
- место, где разделяются электрические заряды
5 вопрос
Какая энергия необходима для разделения в источнике тока электрических зарядов?
Варианты ответов:
- Механическая
- Внутренняя
- Любая из перечисленных или другой вид энергии
- Химическая
6 вопрос
Какой процесс происходит во всех источниках тока?
Варианты ответов:
- Создание потоков заряженных частиц
- Скопление электронов или ионов
- Разделение положительно и отрицательно заряженных частиц
7 вопрос
Сколько полюсов и какие имеет источник тока?
Варианты ответов:
- 2; отрицательный и нейтральный
- 2; положительный и отрицательный
- 3; положительный, отрицательный и нейтральный
8 вопрос
После чего аккумулятор дает электрический ток?
Варианты ответов:
- После того, как его зарядили от другого источника тока
- После того, как наэлектризовали его электроды
- После того, как его согрели в теплом помещении
9 вопрос
Какие превращения энергии происходят при разрядке аккумуляторов?
Варианты ответов:
- Химическая энергия превращается в другие виды энергии в процессе работы, которую совершает ток
- Внутренняя энергия превращается в электрическую энергию
- Электрическая энергия превращается в химическую
10 вопрос
За счет какой энергии происходит разделение заряженных частиц в гальваническом элементе?
Варианты ответов:
- Внутренней
- Энергии химических реакций
- Механической
11 вопрос
Полупроводники …
Варианты ответов:
- частично передают электрический заряд
- хорошо передают электрический заряд
- не передают электрический заряд
12 вопрос
Диэлектрики …
Варианты ответов:
- не передают электрический заряд
- частично передают электрический заряд
- хорошо передают электрический заряд
13 вопрос
Какое действие окажет положительно заряженная палочка на электрон?
Варианты ответов:
- Притянет его
- Не окажет никакого действия
- Оттолкнет его
14 вопрос
Если тела заряжены одноименными зарядами, то они…
Варианты ответов:
- Притягиваются
- Отталкиваются
- Не взаимодействуют
15 вопрос
Что в гальваническом элементе служит положительным электродом, что — отрицательным?
Варианты ответов:
- Положительным — угольный стержень, отрицательным — цинковый сосуд
- Положительным — угольный стержень, отрицательным — слой смолы
- Положительным — слой смолы, отрицательным — цинковый сосуд
Идет подсчет результатов
10
Оцените тест:
8.
( 4 )
Нашли ошибку или нарушение?
Другие тесты автора Давайте пройдем тесты
18 марта 2021 279793
Проходили 205473 раза
Мультфильмы
Кто ты из My Little Pony? Тест
Awdienko
HTML — код
Пройти тест
17 февраля 2021 74748
Проходили 23932 раза
Психология
Тест: Какой у тебя характер?
Awdienko
HTML — код
Пройти тест
20 февраля 2022 62628
Проходили 30913 раз
Прочие тесты
Новый тест на кругозор и эрудицию: 20 занимательных вопросов для проверки ваших знаний.
AlexYasnovidov
HTML — код
Пройти тест
23 ноября 2021 70551
Проходили 19915 раз
Психология
Тест: «Хороший Вы человек или злой?
Awdienko
HTML — код
Пройти тест
31 мая 2021 34957
Проходили 11267 раз
Игры
Тест: Кто ты из Mortal Kombat?
Awdienko
HTML — код
Пройти тест
15 января 2021 66420
Проходили 23143 раза
Психология
Тест на адекватность
Awdienko
HTML — код
Пройти тест
27 января 2022 40080
Проходили 15267 раз
Музыка
Тест: Кто ты из певцов?
Awdienko
HTML — код
Пройти тест
11 июня 2021 66052
Проходили 28722 раза
Музыка
Тест: «Я знаю Егора Крида!»
Awdienko
HTML — код
Пройти тест
18 февраля 2021 64196
Проходили 22468 раз
Психология
Тест: «Мое будущее.
Awdienko
HTML — код
Пройти тест
17 ноября 2021 25342
Проходили 8633 раза
Игры
STANDOFF 2
Андрей Смирнов
HTML — код
Пройти тест
12 марта 2021 48340
Проходили 17496 раз
Психология
Тест: Насколько вы харизматичны?
Awdienko
HTML — код
Пройти тест
31 марта 2021 117973
Проходили 23477 раз
Тесты на IQ
Тест на когнитивные способности
Awdienko
HTML — код
Пройти тест
5 августа 2021 28881
Проходили 9202 раза
Психология
Тест на субкультуру.
Awdienko
HTML — код
Пройти тест
23 марта 2021 95923
Проходили 33340 раз
Психология
Тест на умственную отсталость
Awdienko
HTML — код
Пройти тест
8 июня 2021 47450
Проходили 16926 раз
Психология
Тест. Какое имя вам подходит?
Awdienko
HTML — код
Пройти тест
9 декабря 2020 50853
Проходили 14164 раза
Психология
Тест на психопатию: ты псих или нет?
Awdienko
HTML — код
Пройти тест
Показать еще больше
Самое популярное сейчас По оценкам наших пользователей
4 февраля 2022 29231
Проходили 10037 раз
Психология
Тест: Насколько Вы высокомерны?
Awdienko
HTML — код
Пройти тест
1 июля 2021 33811
Проходили 8939 раз
Прочие тесты
Тест: Какая у тебя суперспособность?
Awdienko
HTML — код
Пройти тест
4 мая 2021 25229
Проходили 7337 раз
Психология
Тест: «Из какой вы страны душой?»
Awdienko
HTML — код
Пройти тест
16 декабря 2020 54653
Проходили 6908 раз
Прочие тесты
Тест на времена английского языка
Awdienko
HTML — код
Пройти тест
3 февраля 2021 78034
Проходили 26154 раза
Игры
Тест: Кто ты из Undertale?
Awdienko
HTML — код
Пройти тест
8 октября 2021 14224
Проходили 4706 раз
Психология
Тест на стервозность
Awdienko
HTML — код
Пройти тест
22 ноября 2021 29984
Проходили 9884 раза
Игры
Тест на знание персонажей из игры Genshin Impact
balynskiy
HTML — код
Пройти тест
27 апреля 2021 44762
Проходили 10035 раз
История
Тест: Екатерина II
Awdienko
HTML — код
Пройти тест
26 ноября 2021 32336
Проходили 11387 раз
Психология
Тест: «Пацанка ты или Леди?»
Awdienko
HTML — код
Пройти тест
24 марта 2021 21321
Проходили 8161 раз
Прочие тесты
Угадай футболиста по фото!
Awdienko
HTML — код
Пройти тест
6 апреля 2021 39109
Проходили 10320 раз
Животные
Тест: Какой ты волк?
Awdienko
HTML — код
Пройти тест
13 октября 2021 6325
Проходили 1213 раз
История
Тест: Внешняя политика Екатерины II
Awdienko
HTML — код
Пройти тест
22 декабря 2020 87738
Проходили 31565 раз
Мультфильмы
Тест: Какая ты принцесса из Disney?
Awdienko
HTML — код
Пройти тест
13 января 2022 2284
Проходили 675 раз
Прочие тесты
Тест на кругозор: поставят ли эти вопросы вас в тупик?
AlexYasnovidov
HTML — код
Пройти тест
4 апреля 2021 60336
Проходили 11667 раз
Прочие тесты
Тест по биологии: «Клетка»
Awdienko
HTML — код
Пройти тест
21 мая 2020 57130
Проходили 35739 раз
Психология
Психологический тест: какой ты человек по характеру?
Илья Кузнецов
HTML — код
Пройти тест
Показать еще больше
Как работает батарея — Любопытно
Представьте себе мир без батареек.
К счастью, у нас есть батарейки. Еще в 150 г. до н.э. в Месопотамии парфянская культура использовала устройство, известное как багдадская батарея, сделанное из медных и железных электродов с уксусом или лимонной кислотой. Археологи считают, что на самом деле это не были батареи, а использовались в основном для религиозных церемоний.
Изобретение батареи в том виде, в каком мы ее знаем, приписывают итальянскому ученому Алессандро Вольта, который собрал первую батарею, чтобы доказать точку зрения другого итальянского ученого, Луиджи Гальвани. В 1780 году Гальвани показал, что лапки лягушек, подвешенных на железных или латунных крючках, будут дергаться при прикосновении к ним зондом из какого-либо другого металла.
Луиджи Гальвани обнаружил, что лапки лягушек, подвешенных на латунных крючках, дергались, если их проткнуть зондом из другого металла. Он думал, что эта реакция была вызвана «животным электричеством» внутри лягушки. Источник изображения: Луиджи Гальвани / Wikimedia Commons.
Вольта, поначалу впечатленный открытиями Гальвани, пришел к выводу, что электрический ток исходит из двух разных типов металла (крючков, на которых висят лягушки, и другого металла зонда) и просто передается через них, а не через них. из тканей лягушек. Он экспериментировал со стопками слоев серебра и цинка, перемежаемых слоями ткани или бумаги, пропитанными соленой водой, и обнаружил, что электрический ток действительно протекал по проводу, прикрепленному к обоим концам стопки.
Батарея Алессандро Вольта: груда цинковых и серебряных листов с вкраплениями ткани или бумаги, пропитанной соленой водой.
Вольта также обнаружил, что, используя различные металлы в куче, можно увеличить величину напряжения. Он описал свои открытия в письме Джозефу Бэнксу, тогдашнему президенту Лондонского королевского общества, в 1800 году. ‘ (мера электрического потенциала) названа в его честь.
Я сам, если не считать шуток, поражаюсь тому, как мои старые и новые открытия… чистого и простого электричества, вызываемого контактом металлов, могли вызвать такой ажиотаж.Алессандро Вольта
Так что же именно происходило с этими слоями цинка и серебра и с дергающимися лягушачьими лапками?
Химия батареи
Батарея представляет собой устройство, которое накапливает химическую энергию и преобразует ее в электричество. Это известно как электрохимия, а система, которая лежит в основе батареи, называется электрохимической ячейкой.
Так откуда электрохимический элемент получает электричество? Чтобы ответить на этот вопрос, нам нужно знать, что такое электричество. Проще говоря, электричество — это тип энергии, производимый потоком электронов. В электрохимической ячейке электроны образуются в результате химической реакции, которая происходит на одном электроде (подробнее об электродах ниже!), а затем перетекают на другой электрод, где они расходуются. Чтобы понять это правильно, нам нужно поближе взглянуть на компоненты клетки и на то, как они собираются вместе.
Электроды
Чтобы создать поток электронов, вам нужно где-то, чтобы электроны текли из , и куда-то, чтобы электроны текли в . Это электроды клетки. Электроны текут от одного электрода, называемого анодом (или отрицательным электродом), к другому электроду, называемому катодом (положительный электрод).
В батарее Вольта анодом был цинк, от которого электроны текли по проводу (при подключении) к серебру, которое было катодом батареи. Он сложил множество этих элементов вместе, чтобы сделать общую кучу и поднять напряжение.
Но откуда анод получает все эти электроны? И почему они так счастливы, что их весело отправляют на катод? Все сводится к химии, которая происходит внутри клетки.
Происходит несколько химических реакций, которые нам нужно понять. На аноде электрод вступает в реакцию с электролитом, в результате которой образуются электроны. Эти электроны накапливаются на аноде. Тем временем на катоде одновременно происходит другая химическая реакция, которая позволяет этому электроду принимать электроны.
Технический химический термин для реакции, включающей обмен электронами, представляет собой реакцию восстановления-окисления, чаще называемую окислительно-восстановительной реакцией.
Каждая из этих реакций имеет определенный стандартный потенциал. Думайте об этой характеристике как о способности/эффективности реакции либо производить, либо поглощать электроны — ее сила в перетягивании каната электронами.
- Стандартные потенциалы для полуреакций
Ниже приведен список полуреакций, которые включают высвобождение электронов либо из чистого элемента, либо из химического соединения. Рядом с реакцией указано число (E 0 ), которое сравнивает силу электрохимического потенциала реакции с силой готовности водорода расстаться со своим электроном (если вы посмотрите вниз по списку, вы увидите, что водородная полуреакция имеет Е 0 нуля).
E 0 измеряется в вольтах.
Причина, по которой этот список настолько интересен, заключается в том, что если вы выберете две реакции из списка и объедините их для создания электрохимической ячейки, значения E 0 подскажут вам, каким образом будет протекать общая реакция: реакция с более отрицательное значение E 0 пожертвует свои электроны другой реакции, и это определяет анод и катод вашей ячейки. Разница между двумя значениями E 0 говорит вам об электрохимическом потенциале вашей ячейки, который в основном является напряжением ячейки.
Итак, если вы возьмете литий и фтор и сумеете соединить их, чтобы сделать элемент батареи, вы получите максимальное напряжение, теоретически достижимое для гальванического элемента. Этот список также объясняет, почему в куче Вольта цинк был анодом, а серебро катодом: полуреакция цинка имеет более низкое (более отрицательное) значение E 0 (-0,7618), чем полуреакция серебра (0,7996).
.
Стандартные потенциалы полуреакций восстановления
(по отношению к стандартному водородному электроду при 25°C)
В° (В) Li + (водный) + e − Li(s) –3,040 Be 2+ (водн.) + 2e − Be(s) –1,99 Al 3+ (водн.) + 3e − Al(s) –1,676 Zn 2+ (водный) + 2e − Zn(s) –0,7618 Ag 2 S(s) + 2e − 2Ag(s) + S 2− (водн.) –0,71 Fe 2+ (водн.) + 2e − Fe(s) –0,44 Cr 3+ (водн.) + e − Cr 2+ (водн.) –0,424 Cd 2+ (водн.) + 2e − Cd(s) –0,4030 PbSO 4 (т) + 2e − Pb(т) + SO 4 2− (водн. )
–0,356 Ni 2+ (водн.) + 2e − Ni(s) –0,257 2SO 4 2− (водн.) + 4H + (водн.) + 2e − S 2 O 6 − 290940048 (водн.) + 2H 2 O(л) –0,25 Sn 2+ (водн.) + 2e − Sn(s) −0,14 2H + (водн.) + 2e − H 2 (г) 0 Sn 4+ (водн.) + 2e − Sn 2+ (водн.) 0,154 Cu 2+ (водн.) + e − Cu + (водный) 0,159 AgCl(s) + e − Ag(s) + Cl − (водн.) 0,2223 Cu 2+ (водн.) + 2e − Cu(s) 0,3419 O 2 (г) + 2H 2 O(ж) + 4e − 4OH − (водн. )
0,401 H 2 SO 3 (водн.) + 4H + (водн.) + 4e − S(т) + 3H 2 O(л) 0,45 I 2 (s) + 2e − 2I − (aq) 0,5355 MnO 4 2− (водн.) + 2H 2 O(ж) + 2e − MnO 2 (тв) + 4OH − 906 0,6 O 2 (г) + 2H + (водн.) + 2e − H 2 O 2 (водный) 0,695 H 2 SeO 3 (водн.) + 4H + + 4e − Se(s) + 3H 2 O(ж) 0,74 Fe 3+ (водн.) + e − Fe 2+ (водн.) 0,771 Ag + (водный) + e − Ag(s) 0,7996 NO 3 − (водн. ) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)
0,94 Br 2 (водн.) + 2e − 2Br − (водн.) 1,087 MnO 2 (т) + 4H + (водн.) + 2e − Mn 2+ (водн.) + 2H 2 O(л) 1,23 О 2 (г) + 4H + (водн.) + 4e − 2H 2 O(л) 1,229 Cr 2 O 7 2- (водн.) + 14H + (водн.) + 6e — 2Cr 3+ 9048 (водн.) 123 О(л) 1,36 Cl 2 (г) + 2e − 2Cl − (водн.) 1,396 Се 4+ (водн.)+е − Се 3+ (водный) 1,44 PbO 2 (тв) + HSO 4 − (водн. ) + 3H + (водн.) + 2e − PbSO 2 2 (2) () 0123 О(л)
1,69 H 2 O 2 (водн.) + 2H + (водн.) + 2e − 2H 2 O(л) 1,763 F 2 (г) + 2е − 2F − (водный) 2,87 Источник: UC Davis ChemWiki
Любые два проводящих материала, вступающих в реакции с разными стандартными потенциалами, могут образовать электрохимическую ячейку, потому что более сильный сможет отбирать электроны у более слабого. Но идеальным выбором для анода был бы материал, который вызывает реакцию со значительно более низким (более отрицательным) стандартным потенциалом, чем материал, который вы выбрали для своего катода. В итоге мы получаем, что электроны притягиваются к катоду от анода (и анод не пытается сильно сопротивляться), и когда у нас есть легкий путь туда — проводящий провод — мы можем использовать их энергию для обеспечения электрического тока.
Разница в стандартном потенциале между электродами примерно равна силе, с которой электроны перемещаются между двумя электродами. Это известно как общий электрохимический потенциал ячейки, и он определяет напряжение ячейки. Чем больше разница, тем больше электрохимический потенциал и выше напряжение.
Чтобы увеличить напряжение батареи, у нас есть два варианта. Мы могли бы выбрать разные материалы для наших электродов, которые придадут клетке больший электрохимический потенциал. Или мы можем сложить несколько ячеек вместе. Когда элементы объединены определенным образом (последовательно), это оказывает аддитивное влияние на напряжение батареи. По сути, силу, с которой электроны движутся через батарею, можно рассматривать как общую силу, когда они движутся от анода первой ячейки через все ячейки, содержащиеся в батарее, к катоду последней ячейки.
Когда ячейки объединены другим способом (параллельно), это увеличивает возможный ток батареи, который можно рассматривать как общее количество электронов, протекающих через ячейки, но не как их напряжение.
Электролит
Но электроды — это только часть батареи. Помните бумажки Вольта, смоченные в соленой воде? Соленая вода была электролитом, еще одной важной частью картины. Электролит может быть жидкостью, гелем или твердым веществом, но он должен обеспечивать движение заряженных ионов.
Электроны имеют отрицательный заряд, и, поскольку мы посылаем поток отрицательных электронов по нашей цепи, нам нужен способ сбалансировать движение этого заряда. Электролит обеспечивает среду, через которую могут протекать положительные ионы, уравновешивающие заряд.
Поскольку химическая реакция на аноде приводит к образованию электронов, для поддержания баланса нейтрального заряда на электроде также производится соответствующее количество положительно заряженных ионов. Они не идут по внешнему проводу (это только для электронов!), а выбрасываются в электролит.
В то же время катод также должен уравновешивать отрицательный заряд электронов, которые он получает, поэтому происходящая здесь реакция должна втягивать положительно заряженные ионы из электролита (в качестве альтернативы она может также высвобождать отрицательно заряженные ионы из электрода в электролит).
Таким образом, в то время как внешний провод обеспечивает путь для потока отрицательно заряженных электронов, электролит обеспечивает путь для передачи положительно заряженных ионов, чтобы сбалансировать отрицательный поток. Этот поток положительно заряженных ионов столь же важен, как и электроны, обеспечивающие электрический ток во внешней цепи, которую мы используем для питания наших устройств. Роль балансировки заряда, которую они выполняют, необходима для поддержания всей реакции.
Теперь, если позволить всем ионам, выпущенным в электролит, полностью свободно перемещаться через электролит, они закончат тем, что покроют поверхности электродов и засорят всю систему. Таким образом, у клетки обычно есть какой-то барьер, чтобы предотвратить это.
Показывать метки во время анимации
Начать анимацию
При использовании батареи возникает ситуация, при которой происходит непрерывный поток электронов (через внешнюю цепь) и положительно заряженных ионов (через электролит).
По мере использования батареи и протекания реакций на обоих электродах производятся новые химические продукты. Эти продукты реакции могут создать своего рода сопротивление, которое может помешать протеканию реакции с той же эффективностью. Когда это сопротивление становится слишком большим, реакция замедляется. Электронное перетягивание каната между катодом и анодом также теряет свою силу, и поток электронов прекращается. Аккумулятор медленно садится.
Зарядка аккумулятора
Некоторые распространенные батареи предназначены только для одноразового использования (известные как первичные или одноразовые батареи). Путешествие электронов от анода к катоду является односторонним. Либо их электроды истощаются, когда они выделяют свои положительные или отрицательные ионы в электролит, либо накопление продуктов реакции на электродах препятствует продолжению реакции, и дело сделано и запылено.
Но. Преимущество этого потока ионов и электронов в том, что он имеет место в некоторых типах батарей с соответствующими материалами электродов, заключается в том, что он также может двигаться в обратном направлении, возвращая нашу батарею в исходную точку и давая ей совершенно новую жизнь. . Точно так же, как батареи изменили то, как мы можем использовать различные электрические устройства, перезаряжаемые батареи еще больше изменили полезность и срок службы этих устройств.
Когда мы подключаем почти разряженную батарею к внешнему источнику электроэнергии и отправляем энергию обратно в батарею, она обращает вспять химическую реакцию, которая произошла во время разряда. Это отправляет положительные ионы, выпущенные из анода в электролит, обратно к аноду, а электроны, которые принял катод, также возвращаются к аноду. Возвращение как положительных ионов, так и электронов обратно в анод запускает систему, поэтому она снова готова к работе: ваша батарея перезаряжена.
Показывать метки во время анимации
Начать анимацию
Однако процесс не идеален. Замена отрицательных и положительных ионов из электролита обратно на соответствующий электрод по мере перезарядки батареи происходит не так аккуратно и красиво, как электрод изначально. Каждый цикл зарядки ухудшает состояние электродов еще немного, а это означает, что батарея со временем теряет производительность, поэтому даже перезаряжаемые батареи не могут работать вечно.
В течение нескольких циклов зарядки и разрядки форма кристаллов батареи становится менее упорядоченной. Это усугубляется, когда батарея разряжается/перезаряжается с высокой скоростью, например, если вы едете на своем электромобиле большими рывками, а не постоянно. Циклирование с высокой скоростью приводит к тому, что кристаллическая структура становится более неупорядоченной, в результате чего батарея становится менее эффективной.
Эффект памяти и саморазряд
Почти полностью обратимые реакции разрядки и перезарядки также способствуют так называемому «эффекту памяти».
В некоторых элементах это вызвано тем, как металл и электролит реагируют с образованием соли (и тем, как соль затем снова растворяется, а металл заменяется на электродах при перезарядке). Мы хотим, чтобы наши клетки имели красивые, однородные маленькие кристаллы соли, покрывающие идеальную металлическую поверхность, но это не то, что мы получаем в реальном мире! Способ формирования некоторых кристаллов очень сложен, и способ осаждения некоторых металлов во время перезарядки также удивительно сложен, поэтому некоторые типы батарей имеют больший эффект памяти, чем другие. Несовершенства в основном зависят от состояния заряда батареи, температуры, зарядного напряжения и зарядного тока. Со временем недостатки в одном цикле зарядки могут вызвать то же самое в следующем цикле зарядки и т.
Еще один аспект перезаряжаемых батарей заключается в том, что химический состав, делающий их перезаряжаемыми, также означает, что они имеют более высокую склонность к саморазряду. Это когда внутри элемента батареи происходят внутренние реакции, даже когда электроды не подключены через внешнюю цепь. Это приводит к тому, что клетка со временем теряет часть своей химической энергии. Высокая скорость саморазряда серьезно ограничивает срок службы батареи и заставляет ее умирать при хранении.
Литий-ионные аккумуляторы в наших мобильных телефонах имеют довольно хорошую скорость саморазряда, около 2–3 % в месяц, и наши свинцово-кислотные автомобильные аккумуляторы также довольно разумны — они имеют тенденцию терять 4–6 %. в месяц. Аккумуляторы на основе никеля теряют около 10–15 процентов своего заряда в месяц, что не очень хорошо, если вы планируете хранить фонарь целый сезон, когда он вам не нужен! Неперезаряжаемая щелочная батарея теряет всего около 2–3 процентов своего заряда в год.
Напряжение, ток, мощность, мощность… в чем разница?
Все эти слова в основном описывают мощность батареи, верно? Ну вроде. Но все они немного разные.
Напряжение = сила, при которой реакция, приводящая в движение батарею, проталкивает электроны через ячейку. Это также известно как электрический потенциал и зависит от разности потенциалов между реакциями, происходящими на каждом из электродов, то есть от того, насколько сильно катод будет тянуть электроны (через цепь) от анода. Чем выше напряжение, тем большую работу может совершить одно и то же число электронов.
Ток = количество электронов, проходящих через любую точку цепи в данный момент времени. Чем больше сила тока, тем больше работы он может совершить при том же напряжении. Внутри ячейки вы также можете думать о токе как о количестве ионов, движущихся через электролит, умноженном на заряд этих ионов.
Мощность = напряжение x ток. Чем выше мощность, тем выше скорость, с которой батарея может работать — это соотношение показывает, насколько важны напряжение и ток для определения того, для чего подходит батарея.
Емкость = мощность батареи как функция времени, которая используется для описания периода времени, в течение которого батарея сможет питать устройство. Аккумулятор большой емкости сможет работать в течение более длительного периода, прежде чем разрядится или разрядится. У некоторых аккумуляторов есть небольшая грустная особенность: если вы попытаетесь извлечь из них слишком много слишком быстро, вовлеченные химические реакции не смогут продолжаться, и емкость уменьшится! Таким образом, мы всегда должны быть осторожны, когда говорим о емкости батареи и помнить, для чего она будет использоваться.
Другой популярный термин — «плотность энергии». Это количество энергии, которое устройство может удерживать на единицу объема, другими словами, какую отдачу вы получаете за свои деньги с точки зрения мощности и размера. С аккумулятором, как правило, чем выше плотность энергии, тем лучше, так как это означает, что аккумулятор может быть меньше и компактнее, что всегда является плюсом, когда он нужен для питания чего-то, что вы хотите держать в кармане.
Для некоторых приложений, таких как хранение электроэнергии на возобновляемой электростанции, такой как ветряная или солнечная электростанция, высокая плотность энергии не является большой проблемой, так как у них, скорее всего, будет достаточно места для хранения батарей. Основной целью такого использования было бы просто хранить как можно больше электроэнергии, как можно безопаснее и дешевле.
Видео: Как работают аккумуляторы? (TED-Ed/YouTube). Посмотреть подробности и расшифровку.
Почему так много типов?
Ряд материалов (раньше это были просто металлы) можно использовать в качестве электродов в батарее. За прошедшие годы было опробовано много-много различных комбинаций, но лишь немногие из них действительно прошли дистанцию. Но зачем вообще использовать разные комбинации металлов? Если у вас есть пара металлов, которые хорошо работают вместе в качестве электродов, зачем возиться с другими?
Различные материалы имеют разные электрохимические свойства, поэтому они дают разные результаты, когда вы кладете их вместе в элемент батареи.
Другие комбинации дадут лишь струйку тока, но они будут поддерживать эту струйку на века. Например, нам не нужно большое количество тока для питания детектора дыма, но мы хотим, чтобы наши детекторы дыма работали долгое время.
Еще одна причина для использования различных комбинаций металлов заключается в том, что часто для получения требуемого напряжения необходимо сложить два или более элемента батареи, и оказывается, что некоторые комбинации электродов складываются вместе гораздо лучше, чем другие комбинации. Например, литий-железо-фосфатные батареи (разновидность литий-ионных батарей), используемые в электромобилях, объединяются вместе для создания систем высокого напряжения (100 и даже более вольт), но вы никогда не сделаете этого с теми никель-кадмиевыми батареями Walkman, которые получают горячий!
Наши различные потребности со временем привели к разработке огромного количества типов батарей.
Эта тема является частью нашей серии статей о батареях, состоящей из четырех частей. Для дальнейшего чтения см. Типы аккумуляторов, литий-ионные аккумуляторы и аккумуляторы будущего.
Инженерная школа Массачусетского технологического института | » Как работает батарея?
Как работает батарея?
Ваши часы, ноутбук и лазерная указка питаются от одного и того же: химии…
Автор: Мэри Бейтс
Существует множество различных типов батарей, но все они работают по одному и тому же принципу. «Аккумулятор — это устройство, способное накапливать электрическую энергию в виде химической энергии и преобразовывать эту энергию в электричество», — говорит Антуан Алланоре, научный сотрудник факультета материаловедения и инженерии Массачусетского технологического института. «Вы не можете поймать и сохранить электричество, но вы можете хранить электрическую энергию в химических веществах внутри батареи».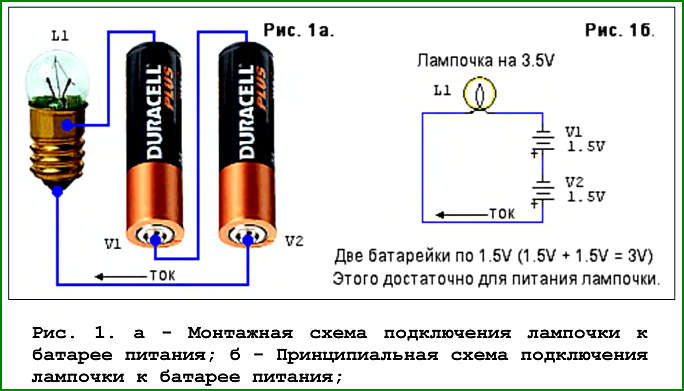
Аккумулятор состоит из трех основных компонентов: двух выводов, изготовленных из различных химических веществ (обычно металлов), анода и катода; и электролит, который разделяет эти клеммы. Электролит представляет собой химическую среду, которая обеспечивает протекание электрического заряда между катодом и анодом. Когда устройство подключено к батарее — лампочке или электрической цепи — на электродах происходят химические реакции, которые создают поток электрической энергии к устройству.
Более конкретно: во время разряда электричества химическое вещество на аноде высвобождает электроны на отрицательную клемму и ионы в электролит посредством так называемой реакции окисления. Между тем, на положительной клемме катод принимает электроны, замыкая цепь потока электронов. Электролит предназначен для того, чтобы привести различные химические вещества анода и катода в контакт друг с другом таким образом, чтобы химический потенциал мог уравновешиваться от одного вывода к другому, преобразовывая накопленную химическую энергию в полезную электрическую энергию.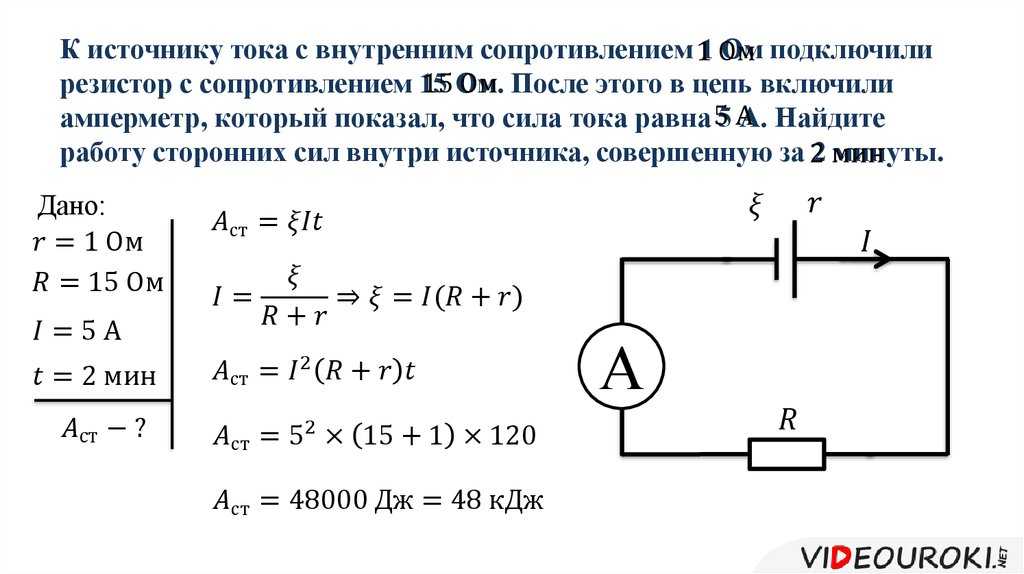
Если батарея одноразовая, она будет производить электричество до тех пор, пока не закончатся реагенты (одинаковый химический потенциал на обоих электродах). Эти батареи работают только в одном направлении, преобразуя химическую энергию в электрическую. Но в других типах аккумуляторов реакция может быть обратной. Перезаряжаемые батареи (например, в вашем мобильном телефоне или в вашем автомобиле) сконструированы таким образом, что электрическая энергия из внешнего источника (зарядное устройство, которое вы подключаете к стене, или динамо-машина в вашем автомобиле) может быть применена к химической системе и наоборот. его работы, восстанавливая заряд аккумулятора.
Лаборатория Group Sadoway в Массачусетском технологическом институте работает над созданием более эффективных аккумуляторов для многократного использования.
 E 0 измеряется в вольтах.
E 0 измеряется в вольтах.  .
.  )
)  )
)  ) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)
) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)  ) + 3H + (водн.) + 2e − PbSO 2 2 (2) () 0123 О(л)
) + 3H + (водн.) + 2e − PbSO 2 2 (2) () 0123 О(л) 
Добавить комментарий